RAPID-TnT
Maxime Tijskens
Professor Chew van de Flinders University of South Australia presenteerde de resultaten van de RAPID-TnT-studie, een gerandomiseerde trial van een 1 uurs-high sensitivity cardiac troponine T (0/1 uur hs-cTnT)-protocol bij vermoeden van een acuut coronair syndroom (ACS). De studie zal ook worden gepubliceerd in Circulation.1
High sensitivity troponins assays laten de detectie toe van zeer lage hoeveelheden myocardiale schade en hebben daarom het potentieel om tot een snellere diagnose van een acuut myocardinfarct (AMI) te komen. Ze hebben bovendien een hoge predictieve waarde zodat een negatief resultaat beschouwd wordt als een goede uitsluiter van ACS.2 Echter bestaat de bezorgdheid dat de hogere sensitiviteit leidt tot meer vervolgonderzoeken met een onduidelijke meerwaarde en mogelijk zelfs complicaties voor de patient.3 Naar aanleiding van de verbeterde diagnostische waarde van high sensitivity troponine T-bepaling ten op zichte van standaard troponinebepaling heeft het ondertussen een plaats verworven in de klinische guidelines.4
In de RAPID-TnT-studie werd een antwoord gezocht op de vraag wat de klinische impact ervan is met betrekking tot outcome en efficiëntie van de spoedgevallendienst. De primaire hypothese was dat een 0/1 uur hscTnT protocol noninferieur is wat betreft klinische outcome na 30 dagen in vergelijking met de huidige standaard praktijkvoering. De secundaire hypothese was dat het veilig was om patiënten met een initieel vermoeden van ACS van op de spoedgevallendienst te ontslaan naar huis op basis van het 0/1 uur hscTnTprotocol (gedefinieerd als overlijden of nieuw/recurrent AMI na 30 dagen < 1 %).
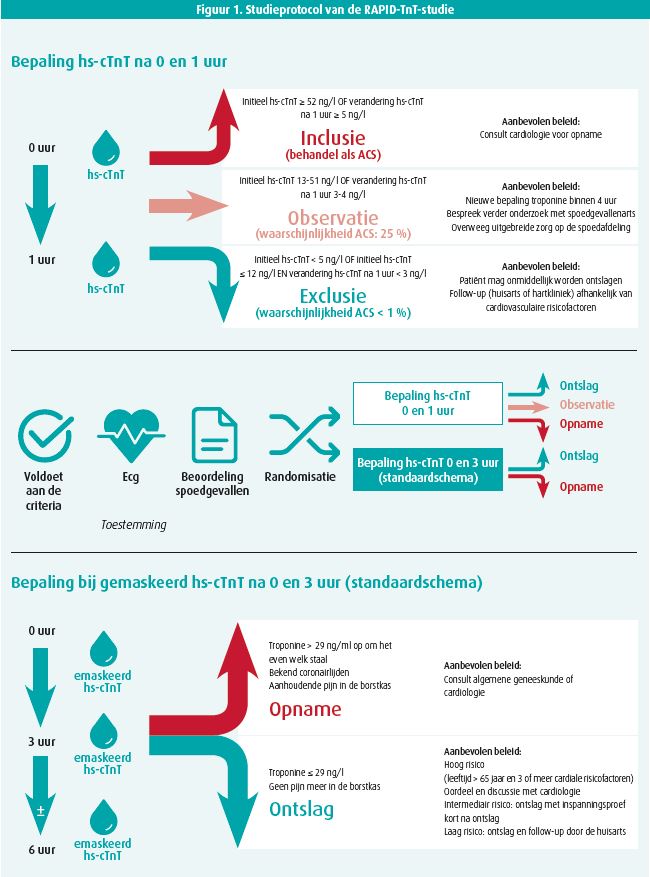
De studie was een prospectieve, op patientenniveau gerandomiseerde, nietinferioriteitsevaluatie van een 0/1 uur hs-cTnT-protocol in vergelijking met een 0/3 uur gemaskeerde hs-cTnT. In de 0/3 uur gemaskeerde hs-cTnT-groep werden de waardes < 29 ng/L gemaskeerd zodat zij niet in rekening gebracht konden worden. Ze werd uitgevoerd in 4 grote spoedgevallendiensten in Adelaide (Australië) in de periode augustus 2015 tot april 2019. Er werden initieel 3 378 patiënten gerandomiseerd met een 1/1-verhouding. Uiteindelijk werden de resultaten van 1 642 patiënten geanalyseerd in de 0/1 uur hs-cTnT-studiearm en 1 646 patiënten in de 0/3 uur gemaskeerde hs-cTnT-studiearm.
Het primaire eindpunt bestond uit een gecombineerd eindpunt van all-cause mortality en nieuw AMI (volgens de 4de universele definitie van AMI) na 30 dagen. De secundaire eindpunten waren all-cause mortality of nieuw ACS na 12 maanden, cardiovasculaire sterfte na 30 dagen en 12 maanden, ongeplande hospitalisatie naar aanleiding van een cardiovasculaire oorzaak (gedefinieerd als niet-electieve coronaire revascularisatie, beroerte, atriale of ventriculaire aritmie en thoracale pijn zonder ACS).
Het studieprotocol wordt weergegeven in figuur 1. Het is belangrijk om te weten dat de randomisatie gebeurde alvorens het eerste troponineresultaat bekend was. Patiënten ouder dan 18 jaar werden geïncludeerd op de dienst Spoedgevallen als hun aanmeldingsklacht thoracale pijn was waarbij een ACS werd vermoed, op het eerste ecg geen afwijkingen waren suggestief voor myocardischemie en ze het informed consent ondertekenden. De exclusiecriteria bestonden uit andere opnamereden dan thoracale pijn, transfer vanuit een ander hospitaal, reeds eerder thoracale pijn in de afgelopen 30 dagen, noodzaak voor permanente hemodialyse en onmogelijke anamnese door comorbiditeit of taalbarrière.
Er was geen verschil in aantal diagnoses van AMI binnen de groep van patiënten met thoracale pijn als reden van spoedpresentatie gebaseerd op 0/1 uur hs-cTnT versus 0/3 uur gemaskeerd hs-cTnT. Het primaire eindpunt was identiek in beide groepen (ongeveer 1 %), onvoldoende om superioriteit te bewijzen maar wel voldoende voor niet-inferioriteit.
45,1 % van de patiënten in de 0/1 uur hs-cTnT-groep en 32,3 % in de 0/3 uur gemaskeerd hs-cTnT-groep konden rechtstreeks ontslagen worden naar huis van de dienst spoedgevallen. In het geheel van gerandomiseerde patiënten werden er minder functionele testen verricht in de 0/1 uur hs-cTnT-studiearm (7,5 % versus 11 %, p < 0,001). Proceduregerelateerde myocardinfarcten (type 4a en type 5) kwamen meer voor in de 0/1 uur hs-cTnT-studiearm (1,6 % versus 1,0 %, p = 0,004). Rehospitalisatie binnen de 30 dagen naar aanleiding van niet-electieve coronaire revascularisatie, hartfalen, beroerte of aritmie (een van de secundaire eindpunten) gebeurde frequenter bij patiënten bij wie het 0/1 uur hs-cTnT werd toegepast (1,41 % versus 0,92 %, p = 0,19).
Professor Chew sloot af met de volgende conclusies:
- Patiënten die op basis van het 0/1 uur hs-cTnT-protocol in de rule-outcategorie vallen kunnen veilig naar huis ontslagen worden van op de spoedgevallendienst. Er kunnen bovendien meer patiënten rechtstreeks van op spoedgevallen worden ontslagen zonder noodzaak tot hospitalisatie en er is minder nood aan functionele testing.
- Implementatie van een 0/1 uur hs-cTnT-protocol lijkt de diagnose van AMI niet te verbeteren, maar de resultaten van outcome en kosteneffectiviteit na 12 maanden zijn nog niet bekend.
- Patiënten met een verhoogd initieel hs-cTnT ≤ 29 ng/L ondergingen meer coronarografieën en coronaire revascularisaties met als nadeel dat zij frequenter werden getroffen door proceduregerelateerde myocardinfarcten.
ENTRUST-AF PCI: anticoagulatie bij patiënten in atriumfibrillatie na een stenting van de kransslagader. Wat met de ENTRUST-AF PCI-studie?
Pascal Vranckx, Andreas Goette
Professor Goette van het St. Vincenz-Hospital in Paderborn (Duitsland) stelde de resultaten van de ENTRUST-AF PCI-studie voor. Deze studie evalueerde de veiligheid van edoxaban in combinatie met een P2Y12-inhibitor in vergelijking met klassieke triple therapy onder vorm van een vitamine K-antagonist (VKA), acetylsalicylzuur en een P2Y12-inhibitor bij patiënten met VKF die een PCI ondergingen en dit gedurende een follow-upduur van 12 maanden. De resultaten werden gelijktijdig gepubliceerd in The Lancet.5 Lees hieronder de bespreking van professor Vranckx en professor Goette.
Ongeveer 7-9 % van de patiënten die een coronaire stenting ondergaan, hebben ook voorkamerfibrillatie.6 Hierbij dringt de vraag zich op naar de meest effectieve (preventie van tromboembolische complicaties), maar ook meest veilige (preventie van bloedingen) anticoagulatie. Combinatie van duale bloedplatjesremming, zoals standaard gebruikt na het plaatsen van een stent in de kransslagaders, en orale anticoagulatie gaat gepaard met een belangrijk bloedingsrisico.7 Over de laatste jaren werd in dit domein meerdere grote gerandomiseerde onderzoeken uitgevoerd waarin het effect van de nietvitamine Kantagonisten (NOACs) werden bestudeerd.8-10
Op het 2019 ESCcongres te Parijs werd op 3 september finaal de ENTRUST-AF PCI-studie voorgesteld waarin het veiligheidsprofiel van duale therapie, onder de vorm van edoxaban 60 mg eenmaal daags in combinatie met een P2Y12-inhibitor, werd vergeleken met een klassieke drieledige ('triple') therapie met een vitamineKantagonist (VKA), een P2Y12-inhibitor en acetylsalicylzuur (duur 1 tot 12 maanden).11 De duale therapie bleek daarbij niet-inferieur t.o.v. een op VKA gebaseerde drieledige behandeling qua optreden van bloedingen. Numeriek was er een duidelijke trend qua reductie van aantal bloedingen (niet statistisch significant voor superioriteit). Het aantal intracraniële en ook fatale bloedingen was eveneens lager in de edoxabangroep in vergelijking met de VKA-groep. Het gecombineerde secundaire eindpunt dood door cardiale oorzaak, beroerte, spontaan myocardinfarct en stenttrombose toonde een vergelijkbaar resultaat in beide studiegroepen. Met 1 500 patiënten was de ENTRUST-AF PCI-studie te klein om een statistisch onderbouwde uitspraak te maken met betrekking tot deze ischemische eindpunten.
Na de PIONEER AF-PCI- (n = 2 124), de RE-DUAL PCI- (n = 2 725), en de AUGUSTUS-studie (n = 4 614) is de ENTRUST-AF PCI-studie (n = 1 506) de vierde gerandomiseerde en gecontroleerde studie met een NOAC die meer licht werpt op de 'ideale' antitrombotische strategie voor deze steeds groter wordende populatie.8-10 Anders dan voor rivaroxaban in de PIONEER AF-PCI-studie, maar zoals in de REDUAL PCI- en AUGUSTUS-studies bestudeerde de ENTRUST-AF PCI-studie de dosis edoxaban (60 mg, eenmaal daags) zoals gebruikt voor de preventie van beroerte in patiënten met voorkamerfibrillatie. 8-10 In de ENGAGE-studie bleek deze dosis minstens even effectief dan VKA in de preventie van beroerte en systeemembolisatie en ging gepaard aan een lager risico op bloedingen en sterfte door cardiovasculaire oorzaken.12
Het resultaat voor het primaire bloedingseindpunt kwam onverwacht. Een mogelijke verklaring daarvoor is te vinden in de eerste weken na de indexinterventie. Bij visuele inspectie van de kaplan-meiercurve voor het primaire eindpunt merkt men een progressieve, volgens een te verwachten patroon, toename van de bloedingseindpunten over de eerste maand in de edoxabangroep. De curve voor de patiënten behandeld met een vitamine K-antagonist (VKA) daarentegen vertoont een onverwachte maar duidelijke knik. Er is zelfs een kruisen van de beide curves. In de eerste twee weken is er een ongunstige verhouding van bloedingseindpunten ten nadele van de met edoxaban behandelde patiënten t.o.v. de met VKA behandelde patiënten, een verhouding die vervolgens omkeert in een blijvend voordeel voor met edoxaban behandelde patiënten voor de rest van de studie. Dat mathematisch fenomeen heeft waarschijnlijk een biologisch correlaat. Daar waar edoxaban 60 mg daags reeds binnen de 2 uur na inname voor een volledige antistolling zorgt, duurt het veel langer voordat de patiënten in de VKA-arm dit niveau bereiken.13 In de eerste twee weken van de studie was er een suboptimale INR-regeling in de groep patiënten behandeld met VKA. Dat verklaart het eerder geringe aantal bloedingseindpunten in de VKA-arm tijdens deze periode. Pas later werd de antistolling in deze groep geoptimaliseerd en finaal eindigde de studie met een gemiddeld aantal patiënten binnen de INR-grens van 2,0 tot 3,0 van 63 %.
Een aandachtspunt is ook het numerieke overwicht in ischemische incidenten (dood door cardiovasculaire oorzaak, myocardinfarct, en stenttrombose) erg vroeg na randomisatie in de edoxabanvs. de VKA-arm. Een signaal dat ook in elk van de andere NOAC-studies werd opgepikt in de armen zonder acetylsalicylzuur. Dat kan mogelijk toegeschreven worden aan clopidogrel. Deze relatief zwakke P2Y12-inhibitor kent een variabiliteit in effect, die zich mogelijk uit in de eerste twee weken na randomisatie wanneer het effect van acetylsalicylzuur, gebruikt tijdens de index percutane coronaire interventie, is uitgewerkt. In de edoxabanarm werd de acetylsalicylzuurbehandeling gestaakt na randomisatie. De gemiddelde duur van interventie tot randomisatie was 45,1 uur, opmerkelijk sneller dan in de AUGUSTUS-studie (6 dagen, interquartile range: 3 to 10).
Duale therapie met edoxaban is op basis van deze resultaten een veilige anticoagulatie naar bloedingsrisico in patiënten met voorkamerfibrillatie na kransslagaderstenting. De ENTRUST-AF PCI-studie, en ook een informele meta-analyse met de drie al voorhanden andere gerandomiseerde studies met de andere NOACs in dit domein (rivaroxaban, PIONEER AF PCI; dabigatran, Re-DUAL PCI; en apixaban, AUGUSTUS), werden gepubliceerd in The Lancet.
Toekomst(visie) en conclusie
Bij patiënten met voorkamerfibrillatie waarbij één of meerdere stents in de kransslagaders worden geplaatst, is het aangewezen de dosis van de orale anticoagulantia te gebruiken zoals getest in de respectievelijke studies in combinatie met dubbele bloedplaatjesremming voor de periode van één week waarna acetylsalicylzuur gestaakt kan worden.
Vooral betrekking tot dit laatste (de duur van acetylsalicylzuur na de indexprocedure) biedt ENTRUST-AF PCI bijkomende informatie welke aansluit bij de resultaten van de AUGUSTUS-studie. ENTRUST-AF PCI versterkt het ondertussen consistent signaal dat het staken van acetylsalicylzuur onmiddellijk na de indexprocedure niet veilig is, in het bijzonder niet bij patiënten met een verhoogd atherotrombotisch risico (i.e. patiënten met een acuut coronair syndroom). Wanneer we de resultaten van ENTRUST-AF PCI en AUGUSTUS naast mekaar leggen en de gemiddelde tijd tussen de indexprocedure en randomisatie van beide studies in acht nemen, ligt de meest optimale behandelduur voor tripletherapie wellicht rond de 7 dagen na de indexprocedure. Een routine tripletherapie voor de duur van één maand, zoals aangegeven in de 2016 behandelrichtlijnen van de Europese vereniging voor Cardiologie14, mag dan wel intuïtief aanlokkelijk zijn maar de snel divergerende curves voor het primaire eindpunt in de AUGUSTUS-studie (acetylsalicylzuur vs. placebo) en de post-hocanalyse van de ENTRUST-AF PCI-trial duiden erop dat dit een nadeel geeft inzake bloedingen. Ook na ENTRUST-AF PCI blijven sommige vragen onbeantwoord. Verder onderzoek naar de meest geschikte bloedplaatjesremming (duur en type) onmiddellijk na de indexprocedure is nodig. Clopidogrel werkt zoals we weten onvoldoende bij ongeveer 40 % van de patiënten, en in de zeer vroege fase na de indexprocedure kan monotherapie zonder acetylsalicylzuur mogelijk gepaard gaan met een onacceptabel hoog trombotisch risico, zelfs onder een NOAC, zoals gesuggereerd in de ENTRUST-AF PCI-studie. Ticagrelor, eventueel aan de lagere dosis van 60 mg tweemaal daags, kan hier een meerwaarde betekenen.
Referenties
- Chew, D.P., et al., A Randomized Trial of a 1-Hour Troponin T Protocol in Suspected Acute Coronary Syndromes: The Rapid Assessment of Possible ACS In the Emergency Department with High Sensitivity Troponin T (RAPID-TnT) Study. Circulation, 2019, [Epub ahead of print].
- Reichlin, T., et al., Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med, 2009, 361 (9), 858-867.
- Jaffe, A.S., White, H. Ruling-In Myocardial Injury and Ruling-Out Myocardial Infarction With the European Society of Cardiology 1-Hour Algorithm. Circulation, 2016, 134 (20), 1542-1545.
- Roffi, M., et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J, 2016, 37 (3), 267-315.
- Vranckx, P., et al. Edoxaban-based versus vitamin K antagonist-based antithrombotic regimen after successful coronary stenting in patients with atrial fibrillation (ENTRUST-AF PCI): a randomised, open-label, phase 3b trial. Lancet, 2019, [Epub ahead of print].
- Capodanno, D., Angiolillo, D.J. Management of antiplatelet and anticoagulant therapy in patients with atrial fibrillation in the setting of acute coronary syndromes or percutaneous coronary interventions. Circulation Cardiovasc Interv, 2014, 7 (1), 113-124.
- Lemesle, G. Aspirin on Top of Anticoagulation in Patients With Concomitant Stable Coronary Artery Disease and Atrial Fibrillation. Circulation, 2019, 139 (5), 617-619.
- Cannon, C.P., Bhatt, D.L., Oldgren, J., Lip, G.Y.H., Ellis, S.G., Kimura, T., et al. Dual Antithrombotic Therapy with Dabigatran after PCI in Atrial Fibrillation. New Engl J Med, 2017, 377 (16), 1513-1524.
- Gibson, C.M., Mehran, R., Bode, C., Halperin, J., Verheugt, F.W., Wildgoose, P., et al. Prevention of Bleeding in Patients with Atrial Fibrillation Undergoing PCI. New Engl J Med, 2016, 375 (25), 2423-2434.
- Lopes, R.D., Heizer, G., Aronson, R., Vora, A.N., Massaro, T., Mehran, R., et al. Antithrombotic Therapy after Acute Coronary Syndrome or PCI in Atrial Fibrillation. New Engl J Med, 2019, 380 (16), 1509-1524.
- Vranckx, P., Lewalter, T., Valgimigli, M., Tijssen, J.G., Reimitz, P.E., Eckardt, L., et al. Evaluation of the safety and efficacy of an edoxaban-based antithrombotic regimen in patients with atrial fibrillation following successful percutaneous coronary intervention (PCI) with stent placement: Rationale and design of the ENTRUST-AF PCI trial. Am Heart J, 2018, 196, 105-112.
- Giugliano, R.P., Ruff, C.T., Braunwald, E., Murphy, S.A., Wiviott, S.D., Halperin, J.L., et al. Edoxaban versus warfarin in patients with atrial fibrillation. New Engl J Med, 2013, 369 (22), 2093-2104.
- Parasrampuria, D.A., Truitt, K.E. Pharmacokinetics and Pharmacodynamics of Edoxaban, a Non-Vitamin K Antagonist Oral Anticoagulant that Inhibits Clotting Factor Xa. Clinical Pharmacokin, 2016, 55 (6), 641-655.
- Kirchhof, P., Benussi, S., Kotecha, D., Ahlsson, A., Atar, D., Casadei, B., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J, 2016, 37 (38), 2893-2962.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.