De uitbraak van de infectieziekte met het nieuwe coronavirus (COVID-19) die eind december 2019 startte in Wuhan, China heeft inmiddels een groot deel van de wereld bereikt. Na de terugkeer midden februari van de wintersporters uit Noord-Italië heeft de epidemie zich ook in ons land vliegensvlug verspreidt. Om de epidemie op te vangen zijn op nationaal, regionaal en lokaal ziekenhuisniveau snel maatregelen genomen met een zeer grote impact op de organisatie van de klinische zorg in de ziekenhuizen, maar ook meer algemeen op de ambulante zorg en opvolging van patiënten. Algehele prioriteit werd en wordt gegeven aan de triage van patiënten verdacht voor COVID-19 en aan de opname van COVID-19-patiënten met een hoog risico op het ontwikkelen van een 'acute respiratory distress syndrome' (ARDS). Alle electieve ingrepen en raadplegingen (zowel intra- als extramuraal) werden geschrapt, de capaciteit van de dienst Intensieve zorgen werd uitgebreid en ziekenhuisafdelingen werden omgebouwd tot COVID-19-afdelingen. De ambulante en klinische cardiologische zorg werd haast volledig teruggeschaald tot de opvang van onmiddellijk levensbedreigende cardiovasculaire aandoeningen en cardiologen werden mee ingezet voor de intensieve verzorging van COVID-19-patiënten.
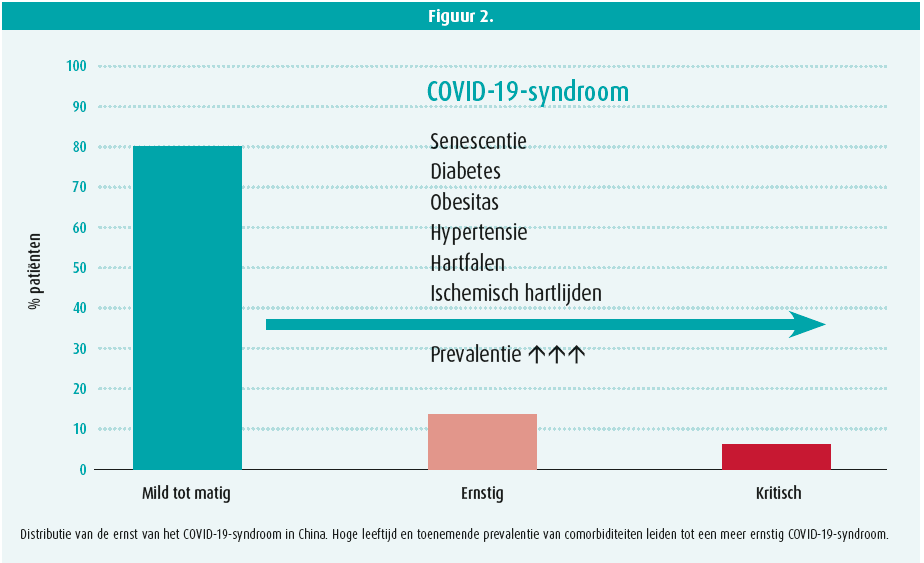
Al uit de eerste rapporten over de uitbraak van de COVID-19-epidemie in China1-3 bleek dat een belangrijk deel van de patiënten chronische cardiovasculaire aandoeningen had. Bovendien bleek de ernst van de aandoening en de mortaliteit exponentieel te stijgen boven de leeftijd van 65 jaar. Dat werd bevestigd door de epidemiologische bevindingen van COVID-19 in Italië: het overlijdensrisico ('case fatality rate') steeg exponentieel van 1,0 % voor patiënten van 50 tot 59 jaar oud tot 20,2 % voor patiënten ouder dan 79 jaar4. Patiënten ouder dan 69 jaar vertegenwoordigen 87,9 % van de overlijdens. Meestal betrof het mannen (70 %) met chronisch ischemisch hartlijden (30 %), diabetes mellitus (20,3 %), een actieve kanker (20,3 %), voorkamerfibrillatie (24,5 %), dementie (68 %) en/of een voorgeschiedenis van een cerebrovasculair accident (9,6 %). De hoge frequentie van een ernstig COVID-19-syndroom en de hoge mortaliteit bij bejaarde mannen met veel comorbiditeiten/risicofactoren zou kunnen verklaard worden door een sterk verminderde immuniteit in deze categorie van patiënten. Andersom kan men zich afvragen of de hoge leeftijd en de frequent aanwezige cardiovasculaire comorbiditeiten en risicofactoren geen voorbeschikkend substraat vormen met een verhoogde susceptibiliteit om een ernstig COVID-19-syndroom te ontwikkelen en erdoor te sterven.
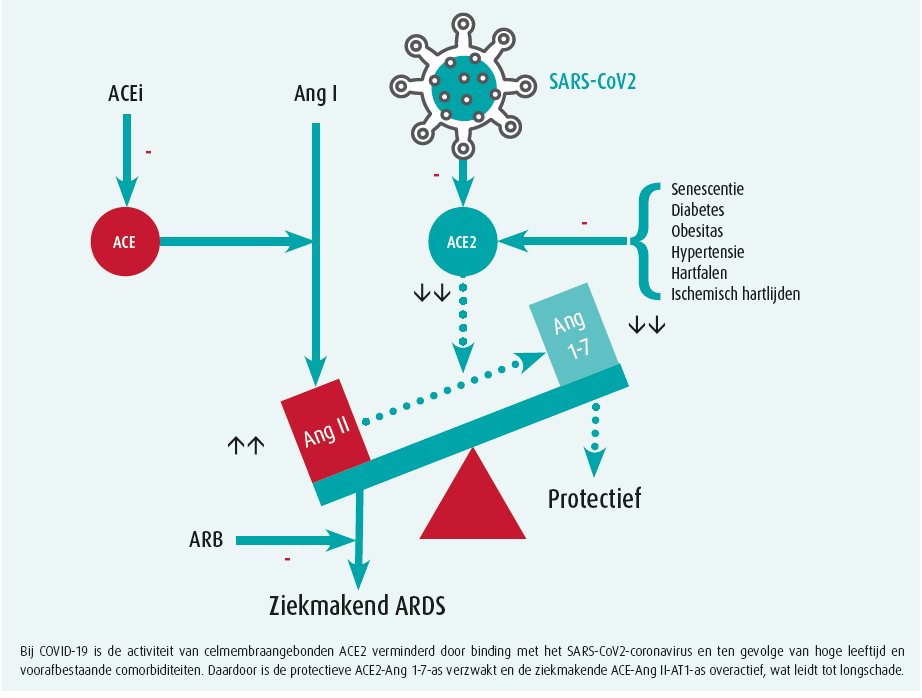
De coronavirussen verantwoordelijk voor het 'severe acute respiratory syndrome' (SARS) (SARS-CoV) en COVID-19 (SARS-CoV2) dringen de cellen die zij infecteren binnen na binding van hun spike-glycoproteïne met het aan de celmembraan gebonden angiontensineconverterend enzym 2 (ACE2)5. Gelet op de hoge prevalentie van diabetes, hypertensie en cardiovasculaire comorbiditeiten bij COVID-19-patiënten ontstond een controverse over het al dan niet voortzetten van een behandeling met angiotensineconverterende enzyme-inhibitoren (ACEI) of met angiotensinereceptorblokkers (ARB). Op basis van dierexperimenteel onderzoek waarbij in het myocard een verhoogde expressie van ACE2-messenger RNA, evenals een verhoogde ACE2-activiteit werd waargenomen onder een behandeling met een ACEI of een ARB6, werd gesuggereerd dat patiënten met diabetes en/of cardiovasculaire aandoeningen behandeld met deze 'ACE2-stimulerende' middelen een verhoogd risico zouden hebben op het ontwikkelen van een ernstig en fataal COVID-197.
De controverse over een mogelijk verhoogd risico op COVID-19 bij een behandeling met ACEI of ARB heeft de aandacht hernieuwd voor de rol van het renine-angiotensinesysteem (RAS) in de fysiopathologie van hartfalen (zowel met verminderde, als met bewaarde ejectiefractie), aan hypertensie, diabetes en obesitas gerelateerde cardiomyopathie8, diabetesnefropathie9, 10, alsook van het 'adult respiratory distress syndrome' (ARDS)11.
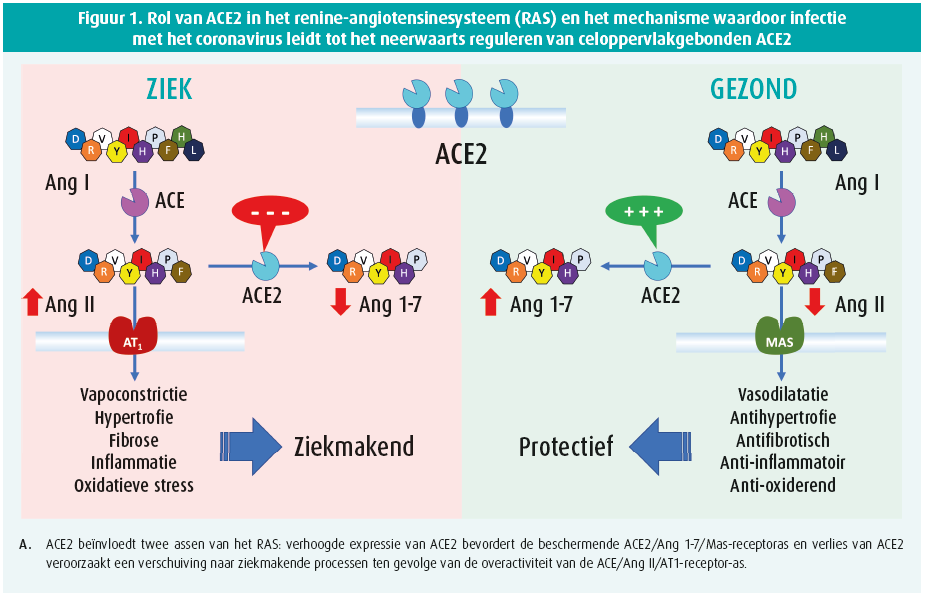
ACE2, een homoloog van het ACE werd al 20 jaar geleden ontdekt. Deze membraangebonden carboxypeptidase is universeel aanwezig in het cardiovasculair systeem maar ook in de long, de darm en in de nier. Het hydrolyseert angiotensine II (Ang II) tot angiotensine 1-7 (Ang 1-7), dat tegengestelde effecten heeft van Ang II. Daardoor heeft dit enzym een tegenwerkende, modulerende rol op de klassieke, meer algemeen bekende ACE-Ang II-angiotensinereceptor 1 (AT1)-as van het RAS. Verzwakking of uitval van de ACE2-Ang (1-7)-as is ziektebevorderend in diverse pathofysiologische toestanden waarbij de ACE-Ang II-AT1-as overgeactiveerd is. De overmaat aan Ang II in deze ziektetoestanden verzwakt verder de protectieve rol van het ACE2 door activatie van het ADAM17-enzym dat ACE losmaakt van de celmembraan waardoor het in de circulatie terechtkomt. Een hoge concentratie van dit oplosbaar ACE2 is een belangrijke merker van een negatieve prognose in patiënten met cardiovasculaire aandoeningen.
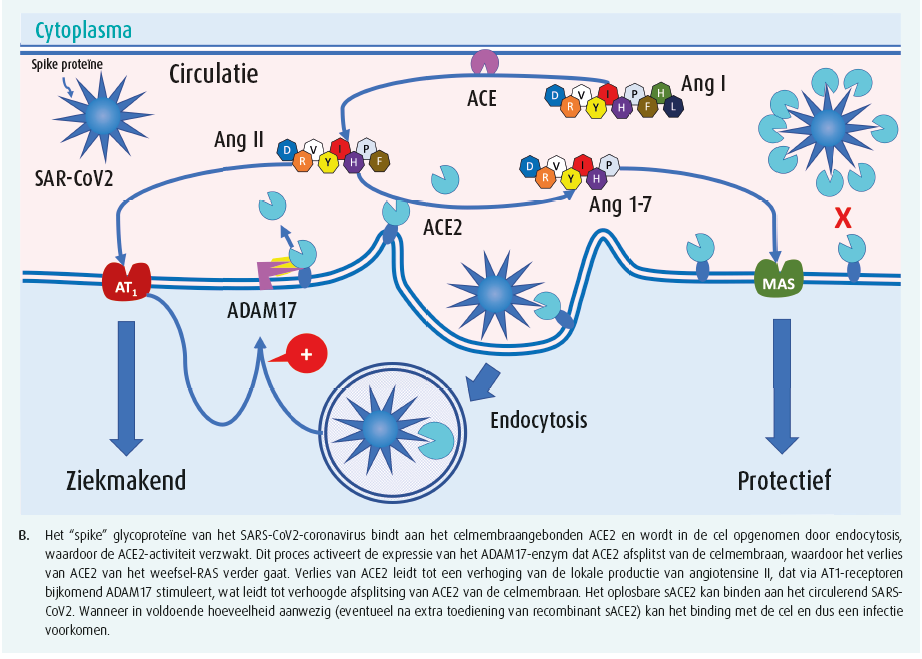
ACE2 is eveneens rijkelijk aanwezig in de long in de alveolaire epitheelcellen en in de endotheelcellen van de longcapillairen. De coronavirussen dringen de cel binnen na binding van de virale spike-glycoproteïne met het ectodomein van ACE2 (figuur 1). Endocytose van het ACE2, verbonden met het viruspartikel vermindert het aantal ACE2-enzymen aan het celoppervlak en verzwakt zo de door ACE2-gemedieerde weefselbescherming. Een aantal positieve feedbackmechanismen versterken bovendien de verminderde ACE2-expressie. De opname van het virus in de cel gaat gepaard met stimulatie van ADAM17, een protease dat het ectodomein van ACE2 van de celmembraan afscheidt. De verhoogde productie van Ang II verhoogt de ADAM17-activiteit, wat nog verder de vrijlating van ACE2 bevordert. ADAM17 stimuleert eveneens vrijstelling van cytokines die op hun beurt andere proteolytische enzymen activeren wat dan weer leidt tot verdere vrijstelling van ACE2 van de celmembraan. Door al deze in mekaar grijpende en versterkende mechanismen veroorzaakt de infectie met het coronavirus in de weefsels een progressieve verzwakking van de beschermende ACE2-Ang (1-7)-as en daardoor een verhoogde activiteit van de ACE-Ang II-AT1-as van het RAS met al de daaraan verbonden ziektebevorderende gevolgen.
Fundamenteel preklinisch onderzoek toont aan dat diffuse alveolaire longbeschadiging, zoals die optreedt na aspiratie of door infectie met corona- of influenzavirussen, wordt bevorderd door activatie van de ACE-Ang II-AT1-as van het RAS door een verminderde activiteit van het ACE211-13. Behandeling met een ARB heeft een beschermend effect tegen de longbeschadiging uitgelokt door aspiratie van zuur11, de spike-proteïne van het coronavirus12 of door LPS14. Toediening van recombinant ACE2 bleek protectief tegen longschade uitgelokt door aspiratie van zuur en verbeterde in grotere proefdieren de ventilatieparameters door LPS uitgelokte ARDS. Dierexperimenteel onderzoek toonde verder eveneens aan dat senescentie gepaard gaat met een belangrijke vermindering van de ACE2-expressie in de long15.
Samenvattend duiden de resultaten van preklinisch onderzoek erop dat ACE2 enerzijds wel de ingangspoort is voor infectie door coronavirussen, maar anderzijds dat de ACE2-Ang (1-7)-as een belangrijke protectieve werking heeft op het ontwikkelen van longschade van het type ARDS. Afremmen van de in de longweefsels overactieve ACE-Ang II-AT1-as door toediening van ACEI of ARB lijkt op basis van deze bevinding eerder protectief tegen het ontwikkelen van een ARDS in het kader van COVID-19. Tal van wetenschappelijke verenigingen en publicaties bevelen daarom aan deze medicaties niet te stoppen bij COVID-19-patiënten16-20.
Preklinisch en klinisch onderzoek geeft ook aan dat de ACE2-Ang (1-7)-as eveneens een belangrijke protectieve rol speelt in het cardiovasculair systeem en dat disfunctie ervan bijdraagt tot de ontwikkeling van diverse vormen van hartfalen ten gevolge van arteriële hypertensie, ischemische hartbeschadiging, diabetes en obesitas8.
De grote verscheidenheid aan klinische presentatie van COVID-19: van lichte respiratoire, nauwelijks op te merken symptomen in jonge kinderen over een influenza-achtig syndroom met hardnekkige, niet-productieve hoest in volwassenen tot een kritische, frequent letale respiratoire insufficiëntie bij oudere patiënten is intrigerend. De toenemende prevalentie van senescentie, obesitas, diabetes, hypertensie, hartfalen en ischemische hartziekten bij patiënten die een ernstig tot kritisch COVID-19-syndroom ontwikkelen suggereert een fysiopathologische betekenis. Het lijkt erop dat de COVID-19-pandemie het meest dodelijk wordt in de intersectie met de zich eveneens pandemisch verspreidende cardiovasculaire aandoeningen21. De directe inactivatie van het celmembraangebonden ACE2, uitgelokt door de cellulaire infectie met het SARSCOV2- virus, is vermoedelijk de trigger die bij bejaarde cardiovasculaire patiënten het fragiele onevenwicht in het RAS tussen de ACE2-Ang (1-7)- en de ACE-Ang II-AT1-as dramatisch verbreekt, wat leidt tot een explosief verloop van de pulmonale infectie met de ontwikkeling van een frequent letaal verlopend ARDS (figuur 2).
Nadat de huidige COVID-19-pandemie uitgewoed zal zijn, zal er vermoedelijk grote aandacht gaan naar de preventie van een volgende infectieuze pandemie. Hopelijk vergeet men niet oog te hebben voor een sterkere preventie van de verder woekerende pandemie van obesitas, diabetes en cardiovasculaire aandoeningen, substraat voor de letaliteit van de huidige COVID-19-pandemie.
Referenties
- Huang, C., Wang, Y., Li, X., et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 2020, 395 (10223), 497-506.
- Chen, N., Zhou, M., Dong, X., et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 2020, 395 (10223), 507-513.
- Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 2020. Available from: https://www.who.int/publications- detail/report-of-the-who-china-joint-mission- on-coronavirus-disease-2019-(covid-19).
- Onder, G., Rezza, G., Brusaferro, S. Case-Fatality Rate and Characteristics of Patients Dying in Relation to COVID-19 in Italy. JAMA, 2020, [Epub ahead of pub].
- Li, W., Moore, M.J., Vasilieva, N., et al. Angiotensin- converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature, 2003, 426 (6965), 450-454.
- Ferrario, C.M., Jessup, J., Chappell, M.C., et al. Effect of Angiotensin-Converting Enzyme Inhibition and Angiotensin II Receptor Blockers on Cardiac Angiotensin-Converting Enzyme 2. Circulation, 2005, 111 (20), 2605-2610.
- Fang, L., Karakiulakis, G., Roth, M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Lancet Respir Med, 2020, 8 (4), e21.
- Patel, V.B., Zhong, J.-C., Grant, M.B., et al. Role of the ACE2/Angiotensin Axis of the Renin-Angiotensin System in Heart Failure. Circulation Res, 2016, 118 (8), 1313-1326.
- Reich, H.N., Oudit, G.Y., Penninger, J.M., et al. Decreased glomerular and tubular expression of ACE2 in patients with type 2 diabetes and kidney disease. Kidney International, 2008, 74 (12), 1610-1616.
- Soler, M.J., Wysocki, J., Batlle, D. ACE2 alterations in kidney disease. Nephr Dialysis Transplant, 2013, 28 (11), 2687-2697.
- Imai, Y., Kuba, K., Rao, S., et al. Angiotensin- converting enzyme 2 protects from severe acute lung failure. Nature, 2005, 436 (7047), 112-116.
- Kuba, K., Imai, Y., Rao, S., et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nature Med, 2005, 11 (8), 875-879.
- Nicholls, J., Peiris, M. Good ACE, bad ACE do battle in lung injury, SARS. Nature Med, 2005, 11 (8), 821-822.
- Wösten-van Asperen, R.M., Lutter, R., Specht, P.A., et al. Acute respiratory distress syndrome leads to reduced ratio of ACE/ ACE2 activities and is prevented by angiotensin-( 1-7) or an angiotensin II receptor antagonist. J Pathol, 2011, 225 (4), 618-627.
- Xudong, X., Junzhu, C., Xingxiang, W., et al. Age- and gender-related difference of ACE2 expression in rat lung. Life Sciences, 2006, 78 (19), 2166-2171.
- de Simone, G. Position Statement of the ESC Council on Hypertension on ACE-Inhibitors and Angiotensin Receptor Blockers 2020. Available from: https://www.escardio.org/ Councils/Council-on-Hypertension-(CHT)/ News/position-statement-of-the-esc-councilon- hypertension-on-ace-inhibitors-and-ang.
- Bozkurt B, Kovacs R, Harrington B. HFSA/ ACC/AHA statement addresses concerns re: using RAAS antagonists in COVID-19. 2020 [cited 2020]. Available from: https://professional. heart.org/professional/ScienceNews/ UCM_505836_HFSAACCAHA-statement-addresses- concerns-re-using-RAAS-antagonists- in-COVID-19.jsp?utm_campaign= sciencenews19-20&utm_source=science- news&utm_medium=email&utm_content= phd03-17-20.
- Krahn, A., Zieroth, S. COVID-19 and concerns regarding use of ACEi/ARB/ARNi medications for heart failure or hypertension 2020. Available from: https://www.ccs.ca/ images/Images_2020/CCS_CHFS_statement_ regarding_COVID_EN.pdf.
- Kuster, G.M., Pfister, O., Burkard, T., et al. SARS-CoV2: should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur Heart J, 2020.
- Bavishi, C., Maddox, T.M., Messerli, F.H. Coronavirus Disease 2019 (COVID-19) Infection and Renin Angiotensin System Blockers. JAMA Cardiol, 2020.
- AlGhatrif M, Cingolani O, Lakatta EG. The Dilemma of Coronavirus Disease 2019, Aging, and Cardiovascular Disease: Insights From Cardiovascular Aging Science. JAMA Cardiol, 2020.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.