Symposiumverslag van het BHRM
De 14de editie van de BHRM (Belgian Heart Rythm Meeting) zou normaal van 22 tot 23 oktober 2020 plaatsvinden in Zaventem, maar gezien de COVID-19-pandemie werd ze voor het eerst volledig virtueel gehouden op dezelfde data. Op vrijdag 23 oktober 2020 vond een sessie plaats die gewijd was aan antistollingsbehandelingen in specifieke populaties. In dit artikel geven we daarvan de grote lijnen weer.Kankerpatiënten
Dr. M. Moonen
Kankerpatiënten lopen een hoger risico op trombose, wat vooral te wijten is aan de activering van de drie belangrijke elementen van de triade van Virchow1 (figuur 1). Ook het risico op recidief is erg hoog in de populatie van kankerpatiënten, namelijk 2 tot 9 keer hoger dan bij patiënten die geen kanker hebben. Als er een veneuze trombose optreedt als complicatie, wijst dat op een slechte prognose, en een embolie vanuit een veneuze trombose is na de kanker zelf de belangrijkste doodsoorzaak in die populatie. Het risico op een veneuze trombose verschilt volgens het type kanker en is het grootst bij kanker van de pancreas en de maag en bij metastasen.
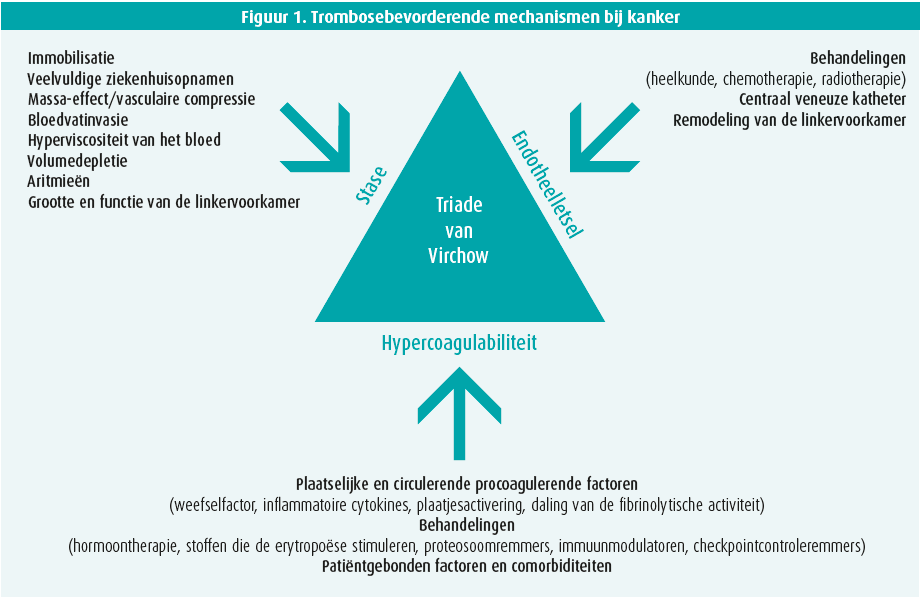
Naast het risico op veneuze trombose is ook het risico op arteriële complicaties groter bij kanker. Zowel coronairlijden, perifere arteriële vaataandoeningen als cerebrovasculaire accidenten (CVA's) komen meer voor, en vormen soms de eerste uiting van een sluipende kanker. Dat risico komt voort uit een complexe interactie tussen het individuele cardiovasculaire risicoprofiel, de kanker en het effect van de antikankerbehandelingen. De pathofysiologische mechanismen zijn complex en omvatten vasospasmen, endotheelletsels, te hoge stollingsstatus, ruptuur van een atheroomplaat en versnelde atherosclerose. Ook die complicaties verhogen het sterfterisico op korte en lange termijn.
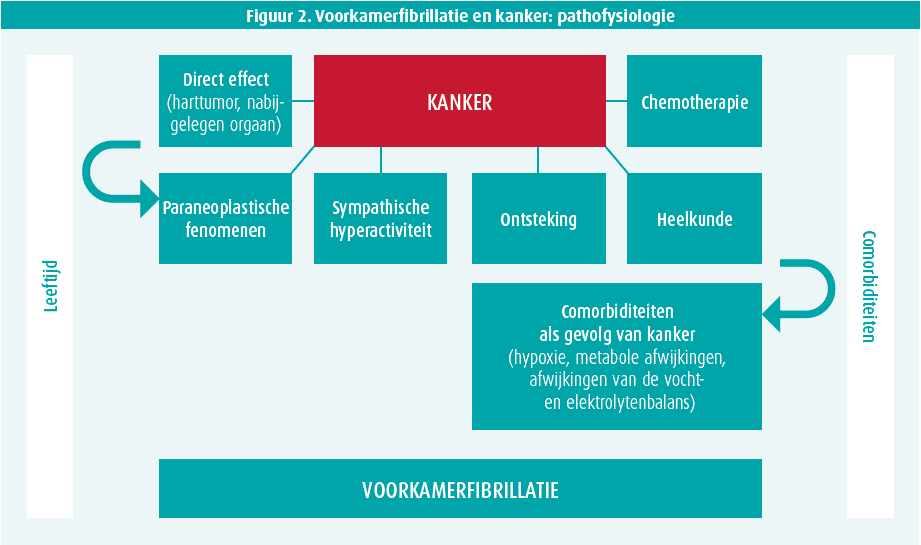
Kanker verhoogt niet alleen het risico op trombose, maar ook op voorkamerfibrilleren (VKF). Die afwijking komt vaker voor bij kankerpatiënten2 en is ook een voorspellende factor voor de morbiditeit en mortaliteit op lange termijn. Kanker en VKF hebben gemeenschappelijke risicofactoren en kanker verhoogt ook het risico op VKF via diverse mechanismen zoals ontsteking, comorbiditeiten, een direct mechanisch effect op nabijgelegen organen, paraneoplastische fenomenen, sympathische hyperactiviteit, of als gevolg van een chirurgische ingreep of chemotherapie (met bv. ibrutinib) (figuur 2).
Een antistollingsbehandeling opstarten bij een kankerpatiënt vormt een hele uitdaging, want die patiënten hebben een hoger bloedingsrisico, worden behandeld met oncologische geneesmiddelen die vaak interacties aangaan met anticoagulantia, vertonen comorbiditeiten die de werkzaamheid van geneesmiddelen aantasten (nierinsufficiëntie, onbeheersbaar braken), zijn vaak ondervoed en kwetsbaar en hebben vaak een laag gewicht. Aangezien er geen specifieke schaal bestaat voor het bloedingsrisico bij kankerpatiënten, moeten bij elk van die patiënten afzonderlijk vijf grote parameters die het risico op bloeding verhogen gecontroleerd worden voor er beslist wordt om antistolling op te starten3: een recente bloeding (< 30 dagen geleden), een creatinineklaring < 30 ml/ min., immobilisatie gedurende meer dan vier dagen, de aanwezigheid van metastasen en < 50 000 bloedplaatjes/mm3.
De eerstelijnsantistollingsbehandeling voor trombotische complicaties bij kankerpatiënten bestaat uit laagmoleculairgewichtheparines (LMWH's). Onlangs is echter uit meerdere publicaties over de nieuwe orale anticoagulantia (NOAC's) gebleken dat die verbindingen in die indicatie niet inferieur zijn aan vitamine K-antagonisten. Een recente meta-analyse4 heeft ook aangetoond dat ze niet inferieur zijn aan dalteparine, maar wel meer bloedingen veroorzaken. Daarom worden NOAC's in de recentste aanbevelingen genoemd als een alternatief voor LMWH's, uitgezonderd bij patiënten met een hoog bloedingsrisico.
Wat de antistollingsbehandeling bij kankerpatiënten met VKF betreft, is de situatie complexer. De beslissing om een langdurige antistollingsbehandeling op te starten, vooral bij patiënten met een lage CHA2DS2-VASc-score, berust immers op een schatting van het cumulatieve risico over een periode van 5 tot 10 jaar bij patiënten die een gunstige tienjaarsprognose hebben, wat bij kankerpatiënten niet noodzakelijk het geval is. Zo is uit gegevens van nationale registers gebleken dat kankerpatiënten met VKF en een lage CHA2DS2-VASc-score vaker een trombo-embolie krijgen dan patiënten die geen kanker hebben, en paradoxaal genoeg minder vaak als hun score ≥ 2 is. Momenteel weten we nog niet welke schaal voor risicoscores het best gebruikt wordt bij kankerpatiënten. In de huidige richtlijnen staan geen specifieke aanbevelingen over het type antistollingsmiddelen dat bij voorkeur gebruikt wordt bij kankerpatiënten met VKF. Onlangs is er echter een meta-analyse gepubliceerd van de drie belangrijkste pivotale studies over NOAC's en van observationele gegevens5. Die lijkt de werkzaamheid en de relatieve veiligheid van die verbindingen in die indicatie bij die specifieke populatie te bevestigen.
Diabetespatiënten
Dr. O. Gach
Type 2-diabetes is een aandoening die het gevolg is van een geleidelijke afname van de werking van de eilandjes van Langerhans in de pancreas bij mensen die na verloop van tijd insulineresistent worden. Dat verlies van werking heeft meerdere oorzaken en is te wijten aan een interactie van genetische, erfelijke en omgevingsgebonden factoren die samenhangen met de levensstijl. In tegenstelling tot wat bij type 1-diabetes het geval is, verloopt type 2-diabetes meestal asymptomatisch. Daardoor wordt die aandoening vaak pas laat vastgesteld, als ze al meerdere jaren aanwezig is, vaak omdat er micro- of macrovasculaire complicaties optreden. Patiënten met type 2-diabetes lopen daardoor meer risico op cardiovasculaire aandoeningen, en met name op trombose. Als we de levensverwachting van patiënten met of zonder diabetes en met of zonder een myocardinfarct in de voorgeschiedenis bekijken, blijkt het hebben van diabetes even belangrijk als een voorgeschiedenis van myocardinfarct. Door de glykemie van die patiënten optimaal te regelen, kunnen we het risico op zowel micro- als macrovasculaire complicaties bij die patiënten beperken.
In het kader van niet-klepgerelateerde VKF en in het kader van het risico op trombose, gaat de aanwezigheid van diabetes met bepaalde bijzonderheden gepaard. Wat het eerste geval betreft, gaat diabetes op zich gepaard met een dubbel zo hoog risico op CVA (en dat risico neemt toe naarmate men de ziekte langer heeft), terwijl VKF op zich dat risico met een factor vijf verhoogt6. Bovendien zorgt een CVA voor een veel slechtere prognose bij diabetespatiënten, want de vijfjaarsoverleving bedraagt in die populatie slechts 20 %. Die twee aandoeningen hebben gemeenschappelijke risicofactoren, zoals de leeftijd, obesitas en hypertensie, waarvan de incidentie in onze populaties toeneemt. Uit het Deense nationale register blijkt dat type 2-diabetes op zich het risico op VKF met 19 % verhoogt. Het vormt dus niet alleen een risicofactor voor het ontstaan van die aritmie, maar is ook een verergerende factor op het vlak van complicaties. We spreken van diabetes met comorbiditeiten als er micro- en/of macrovasculaire complicaties aanwezig zijn. Het risico op VKF is nog hoger bij die patiënten, die tussen 20 en 40 % van de bestudeerde populaties uitmaken in de vier belangrijkste gerandomiseerde studies met NOAC's7-10 (figuur 3).
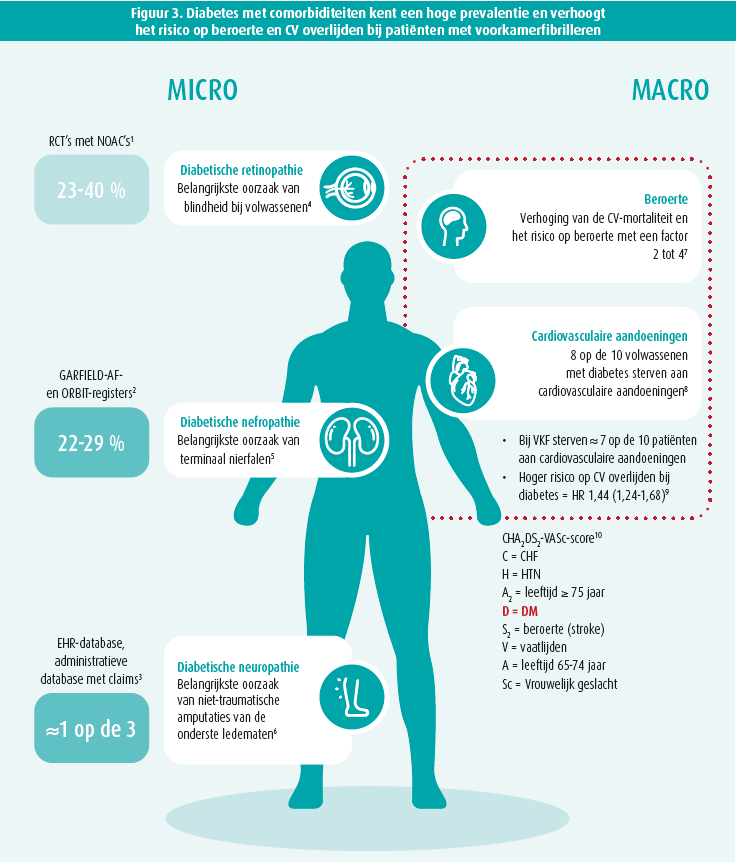
Wat het tweede geval betreft, werden de verschillende risicoscores die gebruikt worden om het risico op trombose en bloeding te voorspellen uitgebreid besproken tijdens de presentatie. We moeten vaststellen dat er rekening gehouden wordt met diabetes bij de schalen die het risico op trombose voorspellen, maar niet bij de schalen die het risico op bloeding voorspellen. Die laatste houden daarentegen allemaal rekening met nierinsufficiëntie. Een originele studie die onlangs gepubliceerd werd sluit daarbij aan. In die studie werden de biologische parameters die wijzen op een achteruitgang van de nierfunctie geanalyseerd bij patiënten die een antistollingsbehandeling met warfarine kregen, en vergeleken met die bij drie andere NOAC's11. Kort samengevat konden de auteurs aantonen dat de nierfunctie minder achteruitging onder NOAC's, en vooral dan onder dabigatran en rivaroxaban.
Tot slot werden in de vier belangrijkste pivotale studies waarin het nut van NOAC's werd aangetoond subanalysen uitgevoerd in de diabetische populatie. In die vier subanalysen werd de gecorrigeerde prognose van diabetespatiënten vergeleken met die bij patiënten zonder diabetes. Algemeen genomen bleek het gecorrigeerde risico op een CVA of systemische embolie hoger in de populatie met diabetes. Ook het gecorrigeerde risico op bloeding was hoger bij patiënten met dan bij patiënten zonder diabetes. De relatieve werkzaamheid van dabigatran was vergelijkbaar bij patiënten die gestratificeerd werden volgens de aan- of afwezigheid van diabetes. Met rivaroxaban was zowel de relatieve werkzaamheid als de relatieve veiligheid van de verbinding vergelijkbaar in de populatie die gestratificeerd werd volgens de aan- of afwezigheid van diabetes, maar hier was ook een gunstig effect op de cardiovasculaire mortaliteit te zien. Apixaban bleef even werkzaam in de populatie met diabetes, maar het percentage ernstige bloedingen was in die populatie even hoog als met warfarine. Ook voor edoxaban tot slot waren de relatieve werkzaamheid en veiligheid vergelijkbaar in de populaties met en zonder diabetes. Een meta-analyse bevestigt dat de aan- of afwezigheid van diabetes geen invloed heeft op de werkzaamheid van de NOAC's wat de bescherming tegen trombo-embolie betreft, en evenmin wat de verlaging van het percentage ernstige bloedingen ten opzichte van warfarine betreft12.
We kunnen dus concluderen dat ongeveer een derde van de diabetespatiënten comorbiditeiten vertoont, dat de aandoening gepaard gaat met een verhoogd risico op CVA, cardiovasculair overlijden, achteruitgang van de nierfunctie en ernstige aandoeningen van de onderste ledematen (amputatie als gevolg van neuropathie en microvasculaire stoornissen). Bij diabetespatiënten met comorbiditeit en een niet-klepgerelateerde VKF is het mogelijk om de micro- en macrovasculaire complicaties te verminderen. Uit recente literatuurgegevens blijkt dat diabetespatiënten met VKF die behandeld worden met NOAC's niet alleen minder risico lopen op een CVA of systemische embolie, maar dat ze ook minder vaak een amputatie moeten ondergaan en dat hun nierfunctie minder snel achteruitgaat.
Referenties
- Mosarla, R.C., Vaduganathan, M., Qamar, A., Moslehi, J., Piazza, G., Giugliano, R.P. Anticoagulation strategies in patients with cancer: JACC Review topic of the week. J Am Coll Cardiol, 2019, 73, 1336-1349.
- Hu, Y-F., Liu, C-J., Chang, P.M., Tsao, H-M., Lin, Y-J., Chang, S-L. et al. Incident thromboembolism and heart failure associated with new-onset atrial fibrillation in cancer patients. Int J Cardiol, 2013, 165, 355-357.
- Kamphuisen, P.W., Beyer-Westenford, J. Bleeding complications during anticoagulant treatment in patients with cancer. Thromb Res, 2014, 133, S49-55.
- Sabatino, J., De Rosa, S., Polimeni, A., Sorrentino, S., Indolfi, C. Direct oral anticoagulants in patients with active câncer: a systemic review and meta-analysis. JACC CardioOncol, 2020, 2, 428-440.
- Cavallari, I., Verolino, G., Romano, S., Patti, G. Efficacy and safety of nonvitamin K oral anticoagulants in patients with atrial fibrillation and cancer: a study-level metaanalysis. Thromb Haemost, 2020, 120, 314- 321.
- Wolf, P.A., Abbott, R.D., Kannel WB, Atrial fibrillation as an independent risk factor for stroke: the Framingham study. Stroke, 1991, 22, 983-988.
- Granger, C.B., Alexander, J.H., McMurray, J.J., Lopes, R.D., Hylek, E.M., Hanna, M.0. et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med, 2011, 365, 981-992.
- Connolly, S.J., Ezekowitz, M.D., Yusuf, S., Eikelboom, J., Oldgren, J., Parekh, A. et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med, 2009, 361, 1139-1151.
- Patel, M.R., Mahaffey, K.W., Garg, J., Pan, G., Singer, D.E., Hacke, W. et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med, 2011, 365, 883-891.
- Giugliano, R.P., Ruff, C., Braunwald, E., Murphy, S.A., Wiviott, S.D., Halperin, J.L. et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med, 2013, 369, 2093-2104.
- Yao, X., Tangri, N., Gersh, B.J., Sangaralingham, L.R., Shah, N.D., Nath, K.A. et al. Renal Outcomes in Anticoagulated Patients with Atrial Fibrillation. J Am Coll Cardiol, 2017, 70, 2621-2632.
- Patti, G., Di Gioia, G., Cavallari, I., Nenna, A. Safety and efficacy of nonvitamin K antagonist oral anticoagulants versus warfarin in diabetic patients with atrial fibrillation: A study-level meta-analysis of phase III randomized trials. Diabetes Metab Res Rev, 2017, vo, e2876.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.