De 7de editie van het BIWAC-congres, state-of-the-art in acute cardiac care, vond digitaal plaats op 18 juni 2021. Tijdens dit congres kwamen vier thema's aan bod: management van acuut coronair syndroom, cardiogene shock/reanimatie, acuut hartfalen en ethische overwegingen bij patiënten die tijdelijk hemodynamisch mechanisch ondersteund worden. In onderstaand verslag worden een aantal besproken topics uitgelicht.
Cardiogene shock
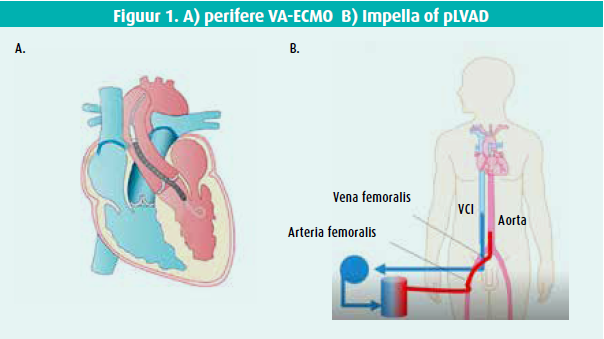
In een pro/contra-debat omtrent de aanpak van cardiogene shock werden twee opties voor mechanische circulatoire ondersteuning tegen elkaar uitgespeeld: het percutane linkerventrikelassistsysteem (pLVAD, Impella®) en veno-arteriële extracorporele membraanoxygenatie (VA-ECMO) (figuur 1).
Impella
T. Balthazar (UZ Brussel)
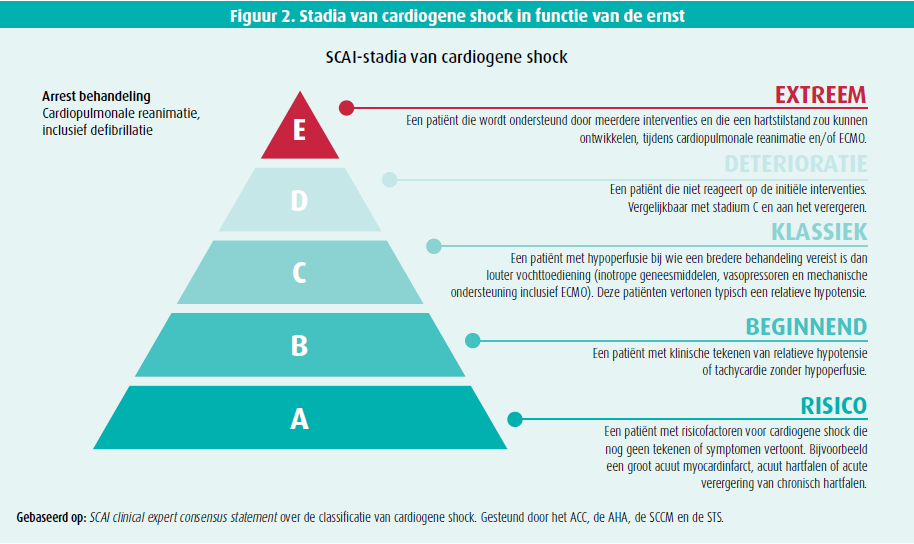
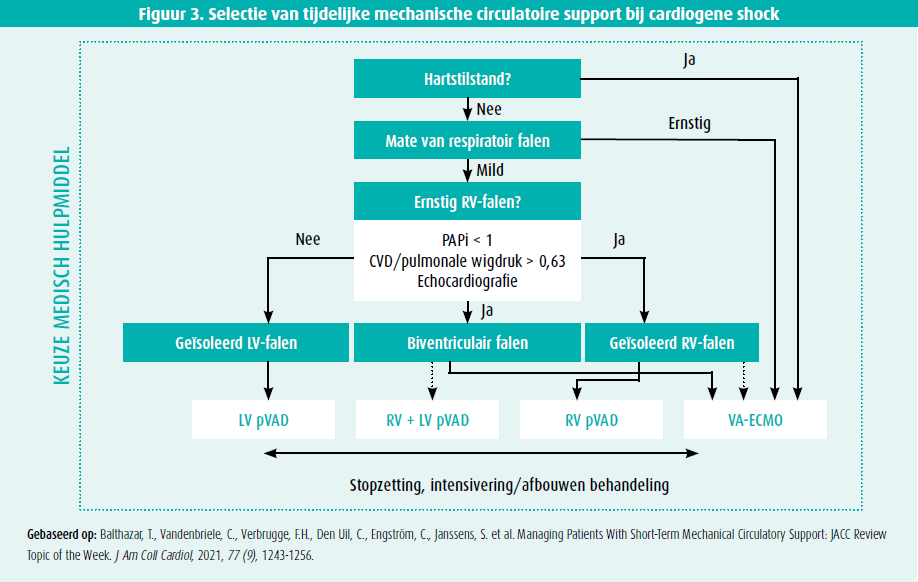
Cardiogene shock kan ingedeeld worden in verschillende fases afhankelijk van de ernst (A -> E volgens de SCAI-indeling, figuur 2). Hoe verder men in de negatieve spiraal van shock belandt, hoe moeilijker het wordt om de shocktoestand om te keren. Indien een medicamenteuze aanpak niet aanslaat, wordt er laagdrempelig overgegaan op mechanische circulatoire ondersteuning (MCS) als brug naar herstel of naar een langetermijnoplossing zoals een permanent linkerventrikelassistdevice (LVAD) of harttransplantatie. Het is belangrijk om het correcte type ondersteuning te selecteren (figuur 3).1 Evidentie rond het gebruik van tijdelijke MCS is echter beperkt. De meeste studies die het gebruik van pLVAD bestuderen, zijn observationeel. De studies die in het voordeel pleiten van Impella (m.n. betere overleving), werden uitgevoerd in ervaren centra met routinegebruik van een cardiogeneshock-protocol en invasieve monitoring m.b.v. een Swan-Ganzkatheter. Bovendien werd het Impella- systeem hierbij vroegtijdig geïmplanteerd (SCAI-stadium A en B, vaak vóór het uitvoeren van een percutane coronaire interventie [PCI]). De studies die geen verschil op overleving konden aantonen, waren daarentegen multicentrisch, met grote verschillen in timing, inclusiecriteria, aanpak en overleving tussen de diverse centra. Tot op heden zijn er dus nog geen solide data voorhanden om het gebruik van Impella te ondersteunen. Toch kan het Impella-systeem een voordeel bieden in geselecteerde patiënten. Het toestel bevordert myocardiaal herstel door ontlasting ('unloading') van het linkerventrikel (LV). Dit is in tegenstelling tot VA-ECMO waarbij de LV-afterload stijgt alsook de LV-einddiastolische druk (LVEDP). Een studie van Swain et al. bij patiënten met een ST-elevatiemyocardinfarct (STEMI) toonde dat unloading van het LV met Impella aanleiding gaf tot reductie van het infarct-gebied, terwijl bij VA-ECMO een neiging bestond tot toename hiervan.2 Wanneer men bovendien het LV ontlastte vooraleer over te gaan tot reperfusie d.m.v. PCI, gaf dit in een pilootstudie bij grote anterior infarcten reductie van de infarctzone. Grotere projecten zijn lopende om deze gegevens te bevestigen. Wanneer toch voor VA-ECMO wordt gekozen, is het vroegtijdig associëren van Impella om de LV-afterload te verlagen eveneens nuttig (een zogenoemde 'ECMELLA'). Pappalardo et al. waren een van de eersten die hierover een grote reeks publiceerden, en de resultaten werden bevestigd door Schrage et al.3,4. Ook hier bleek het grootste voordeel behaald te worden wanneer strategie vroegtijdig werd toegepast (binnen de twee uur na aanmelding). Een lagere complicatiegraad werd gezien in een aantal observationele reeksen in vergelijking met VA-ECMO gezien de kleinere canule (minder vasculaire complicaties) en het kleinere circuit (minder complicaties m.b.t. hemostase). Bij evaluatie van complicaties, is er wel een bepaalde mate van selectiebias. Het zijn immers de meest kritieke patiënten die op VA-ECMO worden geplaatst en dit vaak in urgente omstandigheden, wat het aantal complicaties doet toenemen. In buitenlandse centra wordt Impella profylactisch bij hoogrisico-PCI geïmplanteerd, alvorens over te gaan tot reperfusie. Hierdoor wordt ervaring in niet-urgente setting opgebouwd met lagere complicatiegraad tot gevolg.
VA-ECMO
O. Van Caenegem (UCL Brussel)
VA-ECMO kan perifeer (percutaan of chirurgisch via openen van de lies) of centraal (via sternotomie of thoracotomie) worden geplaatst. Bij perifere canulatie wordt er meestal een drainagecanule (V) in de vena cava inferior via de femoraalvene en een teruggavecanule (A) in aorta descendens via de femoraalarterie geplaatst. Enkele voordelen van Impella werden weerlegd. Zo zijn complicaties frequent bij alle technieken, ook bij Impella. De MAUDE-database, bij 855 patiënten behandeld met Impella, registreerde 16 % vasculaire complicaties en meer dan 30 % bloedingscomplicaties5. Bovendien zorgt VA-ECMO voor een goede ondersteuning van het rechterhart. Andere voordelen zijn het feit dat het systeem kan opgestart worden in een reanimatiesetting (zogenoemde eCPR) en dat er geen fluoroscopie noodzakelijk is bij de plaatsing zodat het gelijk waar (soms prehospitaal) kan worden geplaatst. Daarnaast geeft VA-ECMO ook de mogelijkheid tot respiratoire ondersteuning. Hierbij is het soms wel nodig om tot een andere configuratie over te gaan en een extra veneuze canule te plaatsen om deoxygenatie van de bovenste lichaamshelft (harlekijnsyndroom) te vermijden. Een laatste belangrijk voordeel is de mogelijkheid om onder VA-ECMO tot orgaandonatie over te gaan; hierbij is een correcte en ethische werkwijze belangrijk. Voorts geeft VA-ECMO inderdaad aanleiding tot een verhoging van de LV-afterload en LVEDP. Dit hoeft echter geen nadeel te zijn, aangezien er diverse bewezen strategieën bestaan om het LV te ontlasten (e.g. reductie van de ECMOflow, atriale septostomie, combinatie van MCS, meer invasieve technieken etc.).
Acuut hartfalen
State-of-the-art in acuut hartfalen
F. Verbrugge (UZ Brussel)
Binnen acuut hartfalen bestaat geen one-fits-all strategie, wat het belang van een goede classificatie benadrukt. Op klinische grond onderscheiden we volgende categorieën: acuut of chronisch hartfalen (65 %), longoedeem (16 %), hypertensief hartfalen (11 %), cardiogene shock (4 %) en rechterhartfalen (3 %).6
Cardiogene shock wordt gedefinieerd als onvoldoende hartminuutvolume om te voldoen aan de metabolische basisvereisten voor goede orgaanfunctie en integriteit in rust.7 De systolische bloeddruk op zichzelf is hiervoor een slechte indicator, de nadruk werd gelegd op het belang van enerzijds de diastolische druk en de polsdruk en anderzijds de klinische tekenen van hypoperfusie (lage diurese, mentale status, koude extremiteiten en verhoogd lactaat).
Om een adequate behandeling voor acuut hartfalen te kunnen instellen, dient de congestie- en perfusiestatus van de patiënt te worden ingeschat volgens de Stevensonclassificatie (wet vs. dry, cold vs. warm). Het meest voorkomende profiel in acuut hartfalen zijn patiënten met congestie die een behouden perfusie hebben (warm, wet). Congestie kan onder meer met echocardiografie en duplex lever- en nierbloedvaten worden opgevolgd. Daarbij is het onderscheid tussen misdistributie van volume versus échte volume-overbelasting van belang (figuur 4). Adequate decongestie met diuretica moet worden nagestreefd bij vochtretentie waarbij de respons op diuretica wordt nagegaan, bijvoorbeeld via urinaire natriumexcretie. Het gebruik van vasodilatoren is prognostisch gunstig bij acuut hartfalen, dit in tegenstelling tot inotropica.8 Patiënten met lagere systolische bloeddruk hebben contra-intuïtief het meeste baat bij afterloadreductie door de aanwezigheid van uitgesproken perifere vasoconstrictie.7 Het laagdrempelige gebruik van niet-invasieve ventilatie (NIV) bij acuut longoedeem is aangewezen gezien de ontlasting van het linkerventrikel, afname van ademhalingsarbeid en betere ventilatie-perfusieverhouding. Valkuilen bij het gebruik van NIV zijn de extra belasting voor het rechterventrikel alsook het onnodig uitstellen van sedatie en intubatie wat het myocardiaal zuurstofverbruik doet dalen.7 Er werd gewezen op de nadelige effecten van liberale zuurstoftoediening, zoals coronaire vasoconstrictie; perifere zuurstofsaturatie rond de 90 % is voldoende.

Bij de diagnose van acuut hartfalen dient men steeds op zoek te gaan naar de onderliggende oorzaak en potentieel reversibele factoren. Optimalisatie van disease-modifying therapie is primordiaal.
Inotropie in acuut hartfalen
A. Herpain (ULB Erasme)
De opstart van inotropica dient steeds weloverwogen te zijn gezien de afwezige evidentie op vlak van harde uitkomsten zoals mortaliteit. Het gebruik kent zijn plaats binnen acuut hartfalen bij verminderde cardiale output ondanks een adequaat intravasculair volume en bij voorkeur steeds in combinatie met causale therapie.9 Dobutamine, behorend tot de groep van de B-adrenerge agonisten is het eerste keuzepreparaat. Het gebruik van adrenaline als alternatief werd afgeraden gezien het ongunstige effect op de prognose. Catecholamineblootstelling is schadelijk door het hogere risico op aritmieën, verhoogde myocardiale zuurstofnood met toename van het onevenwicht tussen verbruik en aanbod, immuunparalyse en verkorting van de diastolische fase. Daarnaast kan er bèta-1 receptor downregulatie plaatsvinden. Het relatief nieuwere inotropicum, de calcium sensitizer levosimendan, wint steeds meer aan belang. Alhoewel het in de verschillende studies niet superieur is ten opzichte van dobutamine, kent het wel een gunstiger bijwerkingsprofiel en zou het reno- en cardioprotectieve effecten met zich meedragen. Levosimendan dient in het bijzonder overwogen te worden bij volgende situaties: takotsubo cardiomyopathie, cardiorenaal syndroom, ischemische cardiomyopathie en bij inname van bètablokkade, maar dit blijft vooralsnog gelden als tweedelijnstherapie. Afterloadreductie blijft primordiaal in de behandeling van acuut hartfalen. Inotropie kan kortstondig gebruikt worden, maar bij deterioratie onder ingestelde therapie dient mechanische circulatoire support te worden overwogen.
Acute nierinsufficiëntie in acuut hartfalen
H. Schaubroeck (UZ Gent)
De incidentie van acute nierinsufficiëntie bij acuut hartfalen is hoog (tot 47 %) en beïnvloedt de prognose in negatieve zin.10 Verhoogde creatininewaarden betekenen niet per definitie nierschade, maar weerspiegelen vaak de functionele weerslag van cardiorenale interacties ('pseudo nierinsufficiëntie').11 Verhoogde 'afterload' van de nier ten gevolge van veneuze congestie is de belangrijkste factor in het ontstaan van acute nierinsufficiëntie bij acuut hartfalen. De aanpak van een cardiorenaal dilemma berust op drie pijlers: diuretische respons, adequate decongestie en optimale perfusie. Residuele congestie bij ontslag na hartfalenhospitalisatie is prognostisch ongunstig.12 Het is belangrijk om diuretische resistentie te identificeren door de respons op diuretica in de eerste uren na toediening te evalueren.12 Als lisdiuretica een onvoldoende decongestief effect blijkt te hebben, moet de associatie van acetazolamide of SGLT2-inhibitoren overwogen worden. Beide verminderen de natriumreabsorptie in het proximale deel van de tubulus (sequentiële nefronblokkade).11 Twee RCT's worden op heden uitgevoerd (Advor, Empulse) om het effect van deze strategie op hartfaleneindpunten te bestuderen. Bovendien kunnen aldosterone- antagonisten vroegtijdig worden geïnitieerd, mede als hoeksteen van de onderhoudsbehandeling. Als ondanks sequentiële nefronblokkade de congestie persisteert, kan ultrafiltratie een uitweg bieden. Dit blijft een bail-out-strategie wegens te beperkte evidentie voor routinegebruik.14 Een adequate etiologische aanpak samen met een ziektemodificerende behandeling van het onderliggende hartlijden is tevens de basis voor het management van acute nierinsufficiëntie bij deze patiënten en mogen niet worden stopgezet bij milde deterioratie van de nierfunctie.

Referenties
- Balthazar, T., Vandenbriele, C., Verbrugge, F.H., Den Uil, C., Engström, C., Janssens, S. et al. Managing Patients With Short-Term Mechanical Circulatory Support: JACC Review Topic of the Week. J Am Coll Cardiol, 2021, 77 (9), 1243-1256.
- Swain, L., Reyelt, L., Bhave, S., Qiao, X., Thomas, C.J., Zweck, E. et al. Transvalvular Ventricular Unloading Before Reperfusion in Acute Myocardial Infarction. J Am Coll Cardiol, 2020, 76 (6), 684-699.
- Pappalardo, F., Schulte, C., Pieri, M., Schrage, B., Contri, R., Soeffker, G. et al. Concomitant implantation of Impella(®) on top of veno-arterial extracorporeal membrane oxygenation may improve survival of patients with cardiogenic shock. Eur J Heart Fail, 2017, 19 (3), 404-412.
- Schrage, B., Becher, P.M., Bernhardt, A., Bezerra, H., Blankenberg, S., Brunner, S. et al. Left Ventricular Unloading Is Associated With Lower Mortality in Patients With Cardiogenic Shock Treated With Venoarterial Extracorporeal Membrane Oxygenation: Results From an International, Multicenter Cohort Study. Circulation, 2020, 142 (22), 2095-2106.
- Khalid, N., Rogers, T., Shlofmitz, E., Chen, Y. Khan, J.M., Musallam, A. et al. Adverse events and modes of failure related to the Impella percutaneous left ventricular assist devices: a retrospective analysis of the MAUDE database. EuroIntervention, 2019, 15 (1), 44-46.
- Nieminen, M.S., Brutsaert, D., Dickstein, K., Drexler, H., Follath, F., Harjola, V.P., Hochadel, M. et al. EuroHeart Failure Survey II (EHFS II): a survey on hospitalized acute heart failure patients: description of population. Eur Heart J, 2006, 27, 2725-2736.
- Verbrugge, F.H., Guazzi, M., Testani, J.M., Borlaug, B.A. Altered Hemodynamics and End-Organ Damage in Heart Failure. Circulation, 2020, 142 (10), 998-1012.
- Mebazaa, A., Gheorghiade, M., Piña, I.L., Harjola, V.P., Hollenberg, S.M., Follath, F., Rhodes, A. et al. Practical recommendations for prehospital and early in-hospital management of patients presenting with acute heart failure syndromes. Crit Care Med, 2008, 36, 129-139.
- Farmakis, D., Agostoni, P., Baholli, L., Bautin, A., Comin-Colet, J., Crespo-Leiro, M.G., Fedele, F. et al. A pragmatic approach to the use of inotropes for the management of acute and advanced heart failure: An expert panel consensus. Int J Cardiol, 2019, 297, 83-90.
- Vandenberghe, W., Gevaert, S., Kellum, J.A., Bagshaw, S.M., Peperstraete, H., Herck, I., Decruyenaere, J., Hoste, E.A. Acute Kidney Injury in Cardiorenal Syndrome Type 1 Patients: A Systematic Review and Meta- Analysis. Cardiorenal Med, 2016, 6, 116-128.
- Mullens, W., Damman, K., Testani, J.M., Martens, P., Mueller, C., Lassus, J., Tang, W.H.W. et al. Evaluation of kidney function throughout the heart failure trajectory - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2020, 22, 584-603.
- Metra, M., Davison, B., Bettari, L., Sun, H., Edwards, C., Lazzarini, V. et al. Is worsening renal function an ominous prognostic sign in patients with acute heart failure? The role of congestion and its interaction with renal function. Circ Heart Fail, 2012, 5 (1), 54-62.
- Verbrugge, F. Editor's choice Diuretic resistance in acute heart failure. Eur Heart J Acute Cardiovasc Care, 2018, 7 (4), 379-389.
- Schaubroeck, H., Gevaert, S., Bagshaw, S., Kellum, J., Hoste, E. Acute cardiorenal syndrome in acute heart failure: focus on renal replacement therapy. Eur Heart Acute Cardiovasc Care, 2020, 9 (7), 802-811.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.