Hyponatriëmie is waarschijnlijk de meest complexe elektrolytenstoornis waarmee artsen geconfronteerd worden bij patiënten met hartfalen. In tegenstelling tot bij andere elektrolytenstoornissen bestaat de behandeling immers niet uit het louter toedienen van de elektrolyt met een tekort. Ontleden van de precieze oorzaak van hyponatriëmie bij hartfalen is belangrijk alvorens een behandeling in te stellen. Een recent overzichtsartikel door Kapłon Cieślicka en collega's in Heart legt hier de nadruk op en bespreekt het effect van verschillende klassieke en nieuwe behandelingen voor hartfalen.1
Epidemiologie van hyponatriëmie in hartfalen
Hyponatriëmie of een serum-natriumconcentratie < 135 mmol/l komt voor in 10-25 % bij patiënten gehospitaliseerd met hartfalen.1, 2 Patiënten met hartfalen en hyponatriëmie vertonen meer ernstige symptomen en klinische tekens van volumeoverbelasting en hebben een hoger risico op diureticaresistentie. Onafhankelijk van de klinische presentatie en onderliggende linkerventrikelejectiefractie blijkt hyponatriëmie in hartfalen geassocieerd te zijn aan een slechtere prognose met hoger risico op sterfte en nieuwe ziekenhuisopnames.3, 4 Het blijft tot op heden onduidelijk of deze associatie ook een causaal verband reflecteert en de behandeling van hyponatriëmie bijgevolg consistent resulteert in een verbeterde prognose. Een preciezer onderscheid tussen dilutionele hyponatriëmie of de overmatige retentie van vocht door neurohormonale stimulatie en verminderde nierperfusie en depletionele hyponatriëmie als gevolg van overmatig zoutverlies door behandeling met diuretica is hierbij van belang en vormt een mogelijke verklaring voor tegenstrijdige literatuurgegevens waarbij een correctie van hyponatriëmie tijdens de behandeling van hartfalen niet altijd resulteerde in een verbeterde prognose.5
Hyponatriëmie in hartfalen: dilutie versus depletie
Hyponatriëmie door dilutie
Dilutionele hyponatriëmie of 'verdunning' van plasma wordt typisch gekarakteriseerd door symptomen en klinische tekens van volumeoverbelasting, toegenomen neurohormonale stimulatie en slechte weefselperfusie, in het bijzonder van de nieren. Een belangrijke regulator van de plasmatoniciteit is arginine-vasopressine (AVP) dat vanuit de posterieure hypofyse wordt vrijgezet en waterreabsorptie stimuleert in de verzamelbuizen van het distale nefron (figuur 1). In fysiologische omstandigheden zal een toegenomen plasmatoniciteit de osmotische secretie van AVP stimuleren. Er bestaat een rechtlijnig verband tussen de AVP-concentratie in plasma en de plasmatoniciteit waardoor deze laatste uiterst nauwkeurig gereguleerd is met maximale schommelingen van 1-2 %.6
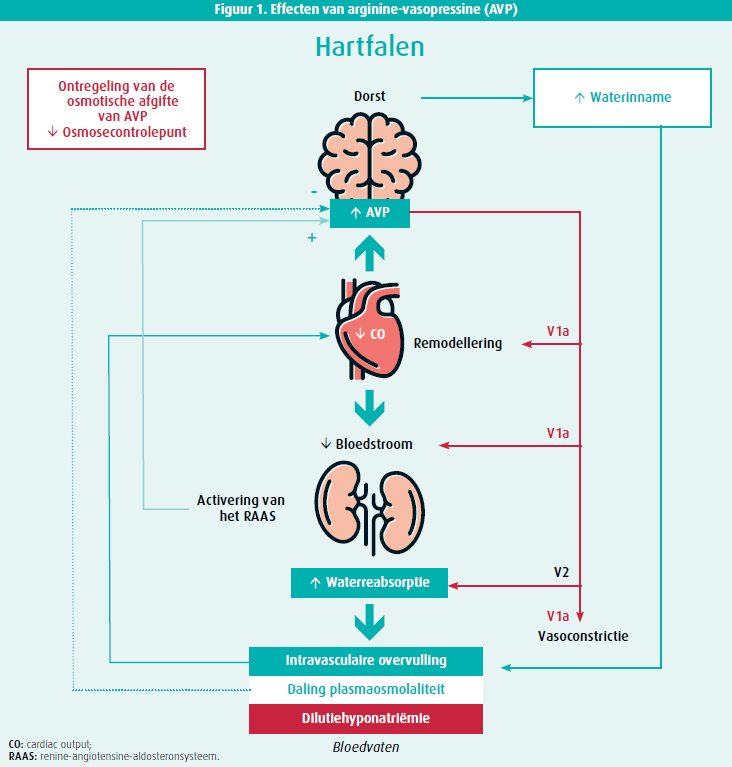
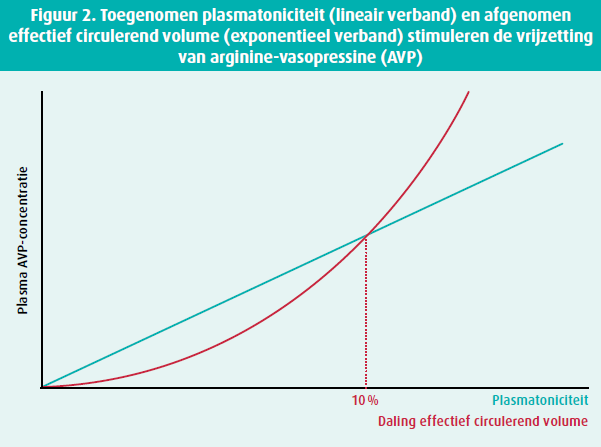
Een meer uitgesproken daling van het effectief circulerende volume met ongeveer 10 % resulteert echter ook in een stijging van AVP. Dit effect wordt in belangrijke mate gemedieerd door activatie van het renine-angiotensine aldosteronesysteem (RAAS), wat het resultaat is van baroreceptoractivatie in de aortaboog, carotis sinus, de lever en het centraal zenuwstelsel (uitgelokt door een lage systemische bloeddruk) en ook van een verminderde nierperfusie. Het verband tussen de AVP-concentratie en de daling van het effectief circulerende volume is exponentieel met sterk verhoogde concentraties in geval van gepercipieerde hypovolemie (figuur 2). Dilutionele hyponatriëmie in hartfalen kan dus min of meer beschouwd worden als een surrogaat marker voor lage cardiale output met gecompromitteerde weefselperfusie. De significant verhoogde AVP-concentraties die hiermee gepaard gaan functioneren niet enkel antidiuretisch (via de V2-receptor), maar werken ook systemische vasoconstrictie en ongunstige cardiale remodellering in de hand (via de V1a-receptor; figuur 1).
Hyponatriëmie door depletie
Ook overdreven zoutverlies door diureticagebruik bij hartfalen kan hyponatriëmie veroorzaken. Concomitante depleties van intracellulaire kationen zoals kalium, calcium en magnesium kunnen dit verder in de hand werken door een shift van natrium naar het intracellulaire compartiment. Ten slotte leidt ook reële hypovolemie via AVP-stimulatie tot diluering van het plasma zoals hierboven uitgelegd.
Impact van hartfalenbehandeling op hyponatriëmie
Diuretica
De distale niertubulus en verzamelbuis vormen het diluerende segment van de nier, gekenmerkt door een lage permeabiliteit voor water. Bijgevolg zullen distaal werkende diuretica zoals thiazideachtige diuretica, mineralocorticoïdereceptorantagonisten (MRA) en amiloride de capaciteit van de nieren om 'vrij water' te excreteren onderdrukken en hyponatriëmie in de hand werken ongeacht het ontstaansmechanisme.2 Lisdiuretica zullen dit niet doen, maar verhinderen de opbouw van een toniciteitsgradiënt in de niermedulla die nodig is voor het concentreren van de urine. Daardoor resulteert hun gebruik in de productie van hypotone urine, wat een zekere bescherming biedt tegen het ontstaan van hyponatriëmie. Lisdiuretica stimuleren echter ook het RAAS en daardoor de niet osmotische vrijzetting van AVP.7 Hierdoor kan (vooral bij langdurig gebruik aan hoge dosissen) toch hyponatriëmie ontstaan, zeker wanneer die (deels) depletioneel van aard is.
Proximaal werkende diuretica zoals acetazolamide zullen de vrijewaterexcretie stimuleren, wat een interessante eigenschap is voor de behandeling van dilutionele hyponatriëmie.2 Door hun werking proximaal van de macula densa verhogen zij het aanbod van zout (en meer bepaald chloor) op deze plaats in het nefron, wat gepaard gaat met een minder uitgesproken RAAS-activatie.7 In een kleine pilootstudie (n = 34) bij patiënten met acuut hartfalen, volumeoverbelasting en uitgesproken neurohormonale activatie gereflecteerd door de aanwezigheid van hyponatriëmie en/of een serum ureum/creatinine-ratio > 50 verbeterde de toevoeging van acetazolamide de respons aan lisdiuretica.8 Zoals alle diureticaklassen, kan echter ook acetazolamide hyponatriëmie veroorzaken wanneer die vooral depletioneel is.
Vasopressine-antagonisten of 'aquaretica'
Gezien de centrale rol van AVP bij het ontstaan van dilutionele hyponatriëmie in hartfalen, lijken AVP-antagonisten een valide optie voor de behandeling ervan. Tolvaptan, een specifieke V2-receptorantagonist, stimuleert de vrijewaterexcretie of aquarese, door een direct effect op de verzamelbuizen in het nefron. Tolvaptan werd onderzocht in de EVEREST-studie, een gerandomiseerde, dubbelblinde, placebogecontroleerde studie bij patiënten met acuut hartfalen, ongeacht de aanwezigheid van hyponatriëmie (n = 4,133). Er kon echter geen voordeel aangetoond worden voor harde klinische eindpunten.9 Patiënten die behandeld werden met tolvaptan vertoonden desalniettemin een meer uitgesproken diurese met een snellere resolutie van symptomen en klinische tekens van volumeoverbelasting, zonder compensatoire RAAS-activatie. Tolvaptanbehandeling ging gepaard met een toename van de plasma-osmolaliteit versus placebo en in een post-hoc analyse bij patiënten met hyponatriëmie ondervond 58 % een resolutie van hyponatriëmie met tolvaptan, terwijl dit slechts bij 20 % het geval was in de placebogroep.10, 11 In de kleine, geselecteerde subgroep met uitgesproken hyponatriëmie < 130 mmol/l (n = 92) werd zelfs een 40 % lager risico vastgesteld op cardiovasculaire dood of ziekenhuisopname door cardiovasculaire oorzaken.10 Mogelijk bieden moleculen die zowel de V1a- als V2- receptor blokkeren zelfs nog bijkomende cardiorenale bescherming.12 Om definitieve besluiten hieromtrent te kunnen trekken, zijn meer en grotere gerandomiseerde studies nodig.
Renine-angiotensine en neprilysineinhibitoren
RAAS-inhibitoren zoals angiotensineconverterende enzyme-inhibitoren en angiotensinereceptorblokkers onderdrukken de neurohormonale stimulatie die dilutionele hyponatriëmie in de hand werkt. Door hun vasodilaterende effecten verbeteren RAAS-inhibitoren vaak ook de cardiale output en weefselperfusie bij patiënten met hartfalen en een verminderde ejectiefractie. Titratie van deze medicatie naar de aanbevolen streefdosis is daarom een goed idee bij patiënten met hartfalen en hyponatriëmie als de bloeddruk dit toelaat. De angiotensinereceptor neprilysine-inhibitor sacubitril/valsartan stimuleert bijkomend het systeem van natriuretische peptiden wat de nierperfusie verder ten goede komt.
Natriumglucose-cotransporter 2-inhibitoren
Natriumglucose-cotransporter 2 (SGLT2) inhibitoren vormen ondertussen een integraal deel van de medicamenteuze hartfalenbehandeling en kunnen het herstel van hyponatriëmie bestendigen. Door stimulatie van glycosurie promoten zij de vrijewaterexcretie.13 In de EMPA-RESPONSE-AHF-studie in acuut hartfalen (n = 80) was een behandeling met empagliflozine inderdaad geassocieerd met een verhoging van de serum-osmolaliteit. 14 Ook bij patiënten met het syndroom van inadequate secretie van antidiuretisch hormoon kan een behandeling met SGLT2-inhibitoren het serum natrium verhogen.15
Toediening van hypertone zoutoplossing met lisdiuretica
Toediening van hypertone zoutoplossing is efficiënt om hyponatriëmie te corrigeren. Het gebruik van deze aanpak bij patiënten met hartfalen blijft echter controversieel. Hypertone zoutoplossing verhoogt onmiddellijk de plasmatoniciteit, wat een aanzuigeffect creëert vanuit het interstitiële/intracellulaire naar het intravasculaire/extracellulaire compartiment en gepaard gaat met een daling van het serum creatinine, een toename van de natriurese en een onderdrukking van de neurohormonale activatie.16 Door deze behandeling te combineren met toediening van lisdiuretica kan het gerekruteerde volume vervolgens worden geëxcreteerd. Tot op heden zijn er echter geen overtuigende gerandomiseerde studies die onderschrijven dat het systematisch toepassen van deze strategie de prognose van patiënten met hartfalen en hyponatriëmie verbetert.
Conclusie
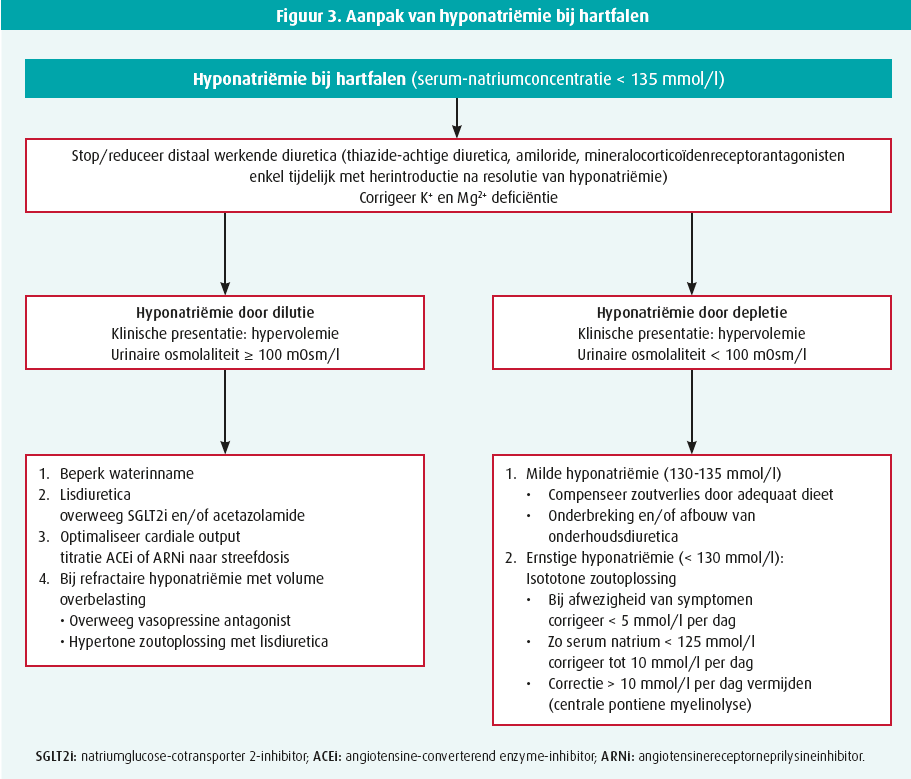
In geval van hyponatriëmie bij hartfalen moet dilutionele hyponatriëmie of de overmatige retentie van vocht door neurohormonale stimulatie en verminderde nierperfusie onderscheiden worden van depletionele hyponatriëmie of overmatig zoutverlies ten gevolge van de behandeling met diuretica. Figuur 3 voorziet een algoritme voor een geïndividualiseerde aanpak. De studies met correct gefenotypeerde hartfalenpatiënten zijn evenwel nodig om de juiste therapeutische modaliteiten voor een patiëntspecifieke hyponatriëmie aan te wenden.
Referenties
- Kaplon-Cieslicka, A., Soloveva, A., Mareev, Y., Cabac-Pogorevici, I., Verbrugge, F.H., Vardas, P. Hyponatraemia in heart failure: time for new solutions? Heart, 2021, [online ahead of print].
- Verbrugge, F.H., Steels, P., Grieten, L., Nijst, P., Tang, W.H., Mullens, W. Hyponatremia in acute decompensated heart failure: depletion versus dilution. J Am Coll Cardiol, 2015, 65, 480-492.
- Gheorghiade, M., Abraham, W.T., Albert, N.M., Gattis Stough, W., Greenberg, B.H., O'Connor, C.M. et al. Investigators O-H and Coordinators. Relationship between admission serum sodium concentration and clinical outcomes in patients hospitalized for heart failure: an analysis from the OPTIMIZEHF registry. Eur Heart J, 2007, 28, 980-988.
- Verbrugge, F.H., Grodin, J.L., Mullens, W., Taylor, D.O., Starling, R.C., Tang, W.H. Transient Hyponatremia During Hospitalization for Acute Heart Failure. Am J Med, 2016, 129, 620-627.
- Lee, S.E., Choi, D.J., Yoon, C.H., Oh, I.Y., Jeon, E.S., Kim, J.J. et al. Improvement of hyponatraemia during hospitalisation for acute heart failure is not associated with improvement of prognosis: an analysis from the Korean Heart Failure (KorHF) registry. Heart, 2012, 98, 1798-1804.
- Verbrugge, F.H. Decongestion: more than meets the eye! Eur J Heart Fail, 2016, 18, 192-194.
- Verbrugge, F.H., Dupont, M., Steels, P., Grieten, L., Swennen, Q., Tang, W.H. et al. The kidney in congestive heart failure: 'are natriuresis, sodium, and diuretics really the good, the bad and the ugly?'. Eur J Heart Fail, 2014, 16, 133-142.
- Verbrugge, F.H., Martens, P., Ameloot, K., Haemels, V., Penders, J., Dupont, M. Acetazolamide to increase natriuresis in congestive heart failure at high risk for diuretic resistance. Eur J Heart Fail, 2019, 21, 1415-1422.
- Konstam, M.A., Gheorghiade, M., Burnett, J.C. Jr., Grinfeld, L., Maggioni, A.P. et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA, 2007, 297, 1319-1331.
- Hauptman, P.J., Burnett, J., Gheorghiade, M., Grinfeld, L., Konstam, M.A. et al. Clinical course of patients with hyponatremia and decompensated systolic heart failure and the effect of vasopressin receptor antagonism with tolvaptan. J Card Fail, 2013, 19, 390-397.
- Vaduganathan, M., Marti, C.N., Mentz, R.J., Greene, S.J., Ambrosy, A.P., Subacius, H.P. et al. Serum Osmolality and Postdischarge Outcomes After Hospitalization for Heart Failure. Am J Cardiol, 2016, 117, 1144-1150.
- Mondritzki, T., Mai, T.A., Vogel, J., Pook, E., Wasnaire, P., Schmeck, C. et al. Cardiac output improvement by pecavaptan: a novel dual-acting vasopressin V1a/V2 receptor antagonist in experimental heart failure. Eur J Heart Fail, 2021, 23, 743-750.
- Verbrugge, F.H., Martens, P., Mullens, W. SGLT-2 Inhibitors in Heart Failure: Implications for the Kidneys. Curr Heart Fail Rep, 2017, 14, 331-337.
- Damman, K., Beusekamp, J.C., Boorsma, E.M., Swart, H.P., Smilde, T.D.J. et al. Randomized, double-blind, placebocontrolled, multicentre pilot study on the effects of empagliflozin on clinical outcomes in patients with acute decompensated heart failure (EMPA-RESPONSE-AHF). Eur J Heart Fail, 2020, 22, 713-722.
- Refardt, J., Imber, C., Sailer, C.O., Jeanloz, N., Potasso, L., Kutz, A. et al. A Randomized Trial of Empagliflozin to Increase Plasma Sodium Levels in Patients with the Syndrome of Inappropriate Antidiuresis. J Am Soc Nephrol, 2020, 31, 615-624.
- Paterna, S., Fasullo, S., Parrinello, G., Cannizzaro, S., Basile, I., Vitrano, G. et al. Short-term effects of hypertonic saline solution in acute heart failure and long-term effects of a moderate sodium restriction in patients with compensated heart failure with New York Heart Association class III (Class C) (SMAC-HF Study). Am J Med Sci, 2011, 342, 27-37.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.