Congresverslag
Natriumglucose-cotransporter 2-inhibitors (SGLT2i) zijn zonder twijfel de meest besproken en bestudeerde cardiovasculaire geneesmiddelen van het moment (tabel 1). Op het jaarlijkse congres van de Europese Vereniging voor Cardiologie (ESC) in Barcelona waren er maar liefst zes volledige sessies gewijd aan deze moleculen en in minstens twaalf andere sessies kwamen ze aan bod. Voor echt nieuwe informatie werd reikhalzend uitgekeken naar hotlinesessie 4 die volledig aan deze medicatieklasse werd besteed.

SGLT2i werden ontwikkeld als anti-diabetesmedicatie. Zoals alle moderne antidiabetica moesten ze cardiovasculaire veiligheid bewijzen in trials gedreven door cardiovasculaire eindpunten. De klasse bleek niet alleen veilig, maar reduceerde verschillende cardiovasculaire eindpunten en niet in het minst hartfalenhospitalisaties, ondanks de beperkte aanwezigheid van hartfalenpatiënten in deze diabetes-trials.1-2 De logische volgende stap was het testen van deze klasse bij patiënten met gekend hartfalen. Vooreerst werden studies bij hartfalen met gereduceerde ejectiefractie (HFrEF) uitgevoerd en dit zowel met de molecule dapagliflozine (DAPA-HF) als empagliflozine (EMPEROR-Reduced). Beide studies waren overtuigend positief met relatieve risicoreducties voor een gecombineerd eindpunt van cardiovasculaire dood en hartfalenhospitalisatie van respectievelijk 26 en 25 % na 1,5 jaar.3-4 Op het ESC-congres van 2021 werden dan de resultaten voorgesteld van empagliflozine bij hartfalen met bewaarde ejectiefractie (HFpEF), een aandoening waar tot dan toe geen echte evidence-based behandeling voor bestond en waar vele andere medicatieklassen (ACE-I, sartaan, ARNI, MRA) hun tanden hadden op stukgebeten. Het werd een mijlpaal in de cardiologie aangezien de EMPEROR-Preserved- studie een 21 % relatiefrisicoreductie toonde in het gecombineerde eindpunt van cardiovasculaire dood en hartfalenhospitalisatie, een resultaat voornamelijk gedreven door een reductie in hartfalenhospitalisaties.5
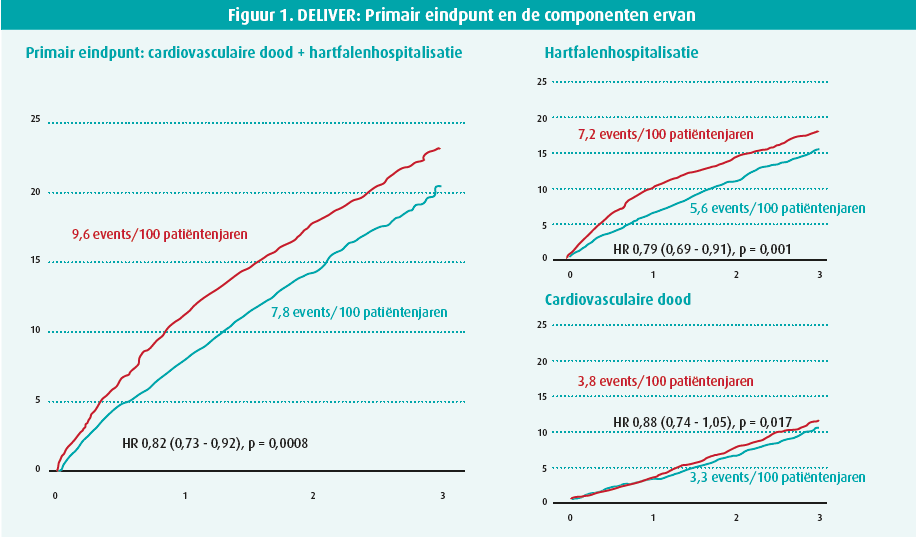
In de hotlinesessie 4 op het ESC 2022 presenteerde Scott Solomon (Boston, VS) vooreerst de resultaten van de DELIVER- studie.6 Deze resultaten werden simultaan gepubliceerd in het New England Journal of Medicine (NEJM) samen met 11 andere subanalyses in verschillende andere tijdschriften. Deze studie bestudeert dapagliflozine in de HFpEF- en HFmrEF-indicatie (hartfalen met mild gereduceerde EF) en zocht dus bevestiging voor de resultaten van de EMPEROR-Preserved-studie. De studiepopulatie bevatte ook patiënten die vroeger HFrEF hadden maar gerecupeerd waren naar een EF > 40 % en een aanzienlijk aantal patiënten waarbij de therapie nog werd gestart in het ziekenhuis tijdens een hospitalisatie voor acuut hartfalen. De diagnose van HFpEF of HFmrEF moest worden ondersteund door een verhoogd NT-proBNP (> 300 pg/ml of > 600 pg/ml in geval van VKF) en een structurele hartafwijking op echo (linkerventrikelhypertrofie of vergroot linkeratrium). De studie was dubbelblind gerandomiseerd naar placebo versus 10 mg dapagliflozine met als primair eindpunt de tijd tot cardiovasculaire sterfte of hartfalenhospitalisatie. Uiteindelijk werden meer dan 6 000 patiënten gerandomiseerd in 20 landen. Het primaire eindpunt werd gereduceerd met 18 %, voornamelijk gedreven door een reductie van 21 % in hartfalenhospitalisatie en een niet-significante reductie in cardiovasculaire mortaliteit van 12 % (figuur 1). Ook bij de echt goede EF (> 60 %) bleef het effect bewaard. De levenskwaliteit, zoals beoordeeld door de Kansas City Cardiomyopathy Questionnaire (KCCQ) verbeterde eveneens in de interventiegroep. Er werden wel geen data getoond over eventuele reductie van alle hospitalisaties (onafhankelijk van de oorzaak). Het is welbekend dat HFpEF-patiënten complex zijn en in EMPEROR-Preserved was slechts 20 % van alle hospitalisaties te wijten aan hartfalen.
Het belang van de DELIVER-studie mocht becommentarieerd worden door Theresa McDonaugh (Londen, VK), die tevens eerste auteur is van de Europese hartfalenrichtlijnen.7 Ze benadrukte in de eerste plaats de opmerkelijke consistentie van de resultaten van de DELIVER-studie in vergelijking met de vorig jaar gepresenteerde EMPEROR-Preserved-studie. Op enkele komma's en punten na, zijn de resultaten bijna elkaars kopie. Dit geeft geloofwaardigheid aan deze resultaten en aangezien het om 2 grote gerandomiseerde studies gaat, opent dit de weg voor een toekomstige IA-richtlijn voor SGLT2i in HFpEF en HFmrEF. Een andere vaststelling is dat het onderscheid in hartfalen, op basis van EF, alvast voor SGLT2i, geen zin heeft. Ze hebben een gunstig effect bij zowel HFrEF, HFmrEF als HFpEF. Eerder uitgevoerde studies met spironolacton en sacubitril/valsartan in de HFpEF-populatie waren eveneens in het voordeel van deze moleculen maar bereikten net geen significantie.8-9 Het lijkt dus zo dat verschillende hartfalenmedicaties, klassiek gebruikt in HFrEF, ook gunstig zijn in HFpEF, zij het met een minder groot effect. Vele auteurs en sprekers beginnen daarom de indeling van hartfalen volgens EF in vraag te stellen.
De overige twee voordrachten in deze sessie brachten geen echte nieuwe data maar trachten meer inzicht te geven in bestaande data door ze te groeperen:
- DAPA-HF en DELIVER (Pardeep Jhund, Glasgow, Scotland): dus dapagliflozine over alle EF heen.10
- DELIVER en EMPEROR-Preserved (Muthiah Vaduganathan, Boston, VS): dus 2 SGLT2i in HFpEF en HFmrEF.11
De eerste analyse toonde dat in de gepoolde data van beide dapagliflozine- studies zowat alle eindpunten (dood door alle oorzaken, cardiovasculaire dood, totale of eerste hartfalenhospitalisatie) significant werden gereduceerd en dit onafhankelijk van EF. De boodschap is dan ook dat een diagnose van hartfalen voldoende is voor een indicatie en EF zelfs niet moet gekend zijn. Deze boodschap kan belangrijk zijn voor een snelle opstart van de medicatie of voor ontwikkelingslanden waar de toegang tot echocardiografie niet universeel is.
De tweede meta-analyse tot slot had slechts weinig additionele waarde mijns inziens. De hoop was waarschijnlijk dat ook het secundaire eindpunt cardiovasculaire dood significant zou worden wanneer de data van beide studies werden verzameld. Dit was echter slechts randsignificant (12 % reductie, p = 0,05).
Alles bij elkaar genomen is het duidelijk dat SGLT2i een blijver is en beschouwd moet worden als foundational therapy in hartfalen onafhankelijk van EF. Het blijft intrigerend wat de exacte mechanismen zijn waardoor dit effect bereikt wordt. Immers, door de onverwacht goede resultaten van de SGLT2i in de diabetesstudies destijds, is men heel snel naar klinische studies gegaan in hartfalen en hinken mechanistische studies wat achterop. In dat opzicht was de sessie 'How do SGLT2 inhibitors act in heart failure', zeer interessant. Uiteraard is er het eerste en meest gekende effect waarbij glucose en natrium worden verwijderd via de nier. Niettemin is het SGLT2-mechanisme verantwoordelijk voor slechts 5 % van de reabsorptie van natrium in de proximale tubulus en is het maximaal natriuretisch effect dus beperkt. Voorheen werd gedacht dat SGLT2i ook verantwoordelijk waren voor de inhibitie van de cardiale natrium-protonuitwisselaar (NHE1). Dit zou dan op zijn beurt kunnen leiden tot een efficiëntere calcium huishouding in de myocardcel met potentieel positieve inotrope en lusitrope effecten. Deze mythe werd echter ontkracht door een serie van zeer mooie cellulaire experimenten zoals gepresenteerd door Robin Shattock (Londen, VK). Daarentegen toonde Peter Light (Edmonton, Canada) aan dat de pathologische late Na+-instroom wel degelijk en overtuigend wordt geïnhibeerd door SGLT2i.12 Dit is belangrijk aangezien deze late Na+-instroom verband houdt met etiologische factoren bij hartfalen en aritmie. Inhibitie hiervan zou verantwoordelijk kunnen zijn voor de geobserveerde lagere incidentie van aritmie en plotse dood in patiënten behandeld met SGLT2i. Of dit ook resulteert in een verwachte verkorting van het QT-interval is nog onduidelijk. Tot slot blijken SGLT2i ook een verschuiving te veroorzaken in het metabolisme van de cardiomyocyten in de richting van ketonen. Deze vormen een zeer interessante bron van energie gezien hun hoge energetische waarde.
Samengevat zullen SGLT2i een van de meest gebruikte klassen van geneesmiddelen worden in het cardiovasculaire systeem dankzij de overtuigende klinische studies, hun veiligheidsprofiel en gebruiksgemak.
Referenties
- Zinman, B., Wanner, C., Lachin, J., Fitchett, D., Bluhmki, E., Hantel, S. et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med, 2015, 373 (22), 2117-2128.
- Wiviott, S., Bonaca, M., Mosenzon, O., Kato, E., Cahn, A., Silverman, M. et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med, 2019, 380 (4), 347-357.
- Packer, M., Anker, S., Butler, J., Filippatos, G., Pocock, S., Carson, P. et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med, 2020, 383 (15), 1413-1424.
- McMurray, J., Solomon, S., Inzucchi, S., Kober, L., Kosiborod, M., Martinez, F. et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med, 2019, 381 (21), 1995-2008.
- Anker, S., Butler, J., Filippatos, G., Ferreire, J., Bocchi, E., Böhm, M. et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med, 2021, 385 (16), 1451-1461.
- Solomon, S., McMurray, J., Claggett, M., De Boer, R., Demets, D., Hernandez, A. et al. Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction. N Engl J Med, 2022, 387 (12), 1089-198.
- McDonagh, T., Metra, M., Adamo, M., Gardner, R., Baumbach, A., Böhm, M. et al. 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2021, 42 (36), 3599-3726.
- Pitt, B., Pfeffer, M., Assmann, S., Boineau, R., Anand, I., Claggett, B. et al. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med, 2014, 370 (15), 1383-1392.
- Solomon, S., McMurray, J., Anand, I., Ge, J., Lam, C., Maggioni, A. et al. Angiotensinneprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med, 2019, 381 (17), 1609-1620.
- Jhund, P., Kondo, T., Butt, J., Docherty, K., Claggett, B., Desai, A. et al. Dapagliflozin across the range of ejection fraction in patients with heart failure: a patient-level, pooled meta-analysis of DAPA-HF and DELIVER. Nat Med, 2022, 28 (9), 1956-1964.
- Vaduganathan, M., Docherty, K., Claggett, B., Jhund, P., De Boer, R., Hernandez, A.F. et al. SGLT-2 inhibitors in patients with heart failure: a comprehensive meta-analysis of five randomized controlled trials. The Lancet, 2022, 400 (10354), 757-767.
- Philippaert, K., Kalyaanamoorthy, S., Fatehi, M., Long, W., Soni, S., Byrne, N. et al. Cardiac late sodium channel current is a molecular target for the sodium/glucose cotransporter 2 inhibitor empagliflozin. Circulation, 2021, 143 (22), 2188-2204.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.