ESC-congresverslag
Op 28 augustus werd op het ESC-congres in Barcelona een sessie gehouden over de paradigmashift in de behandeling van dyslipidemie. Dit symposium werd gemodereerd door Michel Farnier (Dijon, Frankrijk) en Alberto Zambon (Padua, Italië).
Een verhoogde LDL-cholesterol (LDL-c) is een risicofactor voor atherosclerotische hart- en vaatziekten (ASHVZ). LDL-verlaging is bijgevolg cruciaal om een atherosclerotisch cardiovasculair event (CVE) te voorkomen. Momenteel is er evidentie voor statines, ezetimibe en PCSK9-inhibitoren en vindt men in de literatuur drie lipidenverlagende strategieën: 1) 'Step by step approach', een stapsgewijze aanpak (< Europese richtlijnen), 2) 'Planning therapy strategy', gebaseerd op het baseline LDL-C-level (< consensus papers), 3) 'Maximized therapy strategy', waarbij onmiddellijk maximale therapie gestart wordt (< opiniepapers). De verdere sessie is opgedeeld in twee presentaties.
From statins to earlier combination use
Francois Schiele - Besançon, Frankrijk
Het doel van de eerste spreker was het publiek overtuigen van de meerwaarde van vroege combinatietherapie bij patiënten met dyslipidemie. Het huidige paradigma, aangehaald in de ESC-richtlijnen1, 2, berust op een stapsgewijze strategie waarbij het cardiovasculaire risicoprofiel van de patiënt eerst beoordeeld wordt. Op basis van het risicoprofiel en de daarbij horende 'ideale LDL-c-waarde' (oftewel 'LDL-c-doelstelling') kan worden beslist de LDL-c-verlagende behandeling op te starten. Het wordt aangeraden hiervoor een bepaalde behandelvolgorde aan te houden: 1) steeds levensstijlmaatregelen, zo onvoldoende aangevuld met 2) een statine (in opbouwende intensiteit, initiële intensiteit afhankelijk van het risicoprofiel en de LDL-c-doelstelling), 3) ezetimibe, en 4) PCSK9-inhibitoren. Tussen elke stap wordt een tussenperiode van 4-6 weken aangeraden om het effect van de therapiewijziging te evalueren. Bij patiënten met een recent acuut coronair syndroom wordt aangeraden steeds met een statine met hoge intensiteit te starten. Het voordeel van deze stapsgewijze lipidenverlagende benadering is dat het toelaat om een 'te intensieve' behandeling en 'te lage' LDL-c-waarde en dus overbehandeling te voorkomen. Een groot nadeel is de tijd nodig tot het bereiken van de LDL-c-doelstelling.
Ondertussen hebben een aantal observationele studies aangetoond dat deze strategie niet succesvol is vanwege slechte implementatie in de klinische praktijk. Zo blijkt uit de DA VINCI-studie3 dat slechts 37,5 % van de patiënten uit de zeerhoogrisicocategorie een hoog potent statine krijgt. Slechts 9,3 % krijgt een combinatie van een statine met ezetimibe en amper 1,1 % een combinatie met een PCSK9-inhibitor. Verder blijkt dat slechts 18 % van deze zeerhoogrisicopatiënten de LDL-c-doelstelling haalt. Ook het verder opdrijven van de behandeling tijdens de verdere opvolging blijft vaak uit. Sterker nog, in de EUROASPIRE V-studie ziet men zelfs vaker een afbouw in intensiteit, namelijk in een vijfde van de patiënten, en een onderbreking van de behandeling in 11,7 %.4
Een nieuw paradigma met als motto 'lager is beter, eerder is beter en een grotere reductie is beter' wordt vervolgens voorgesteld met als doel onnodige tijdrovende stappen te vermijden. In de SWEDEHEART-studie werd immers aangetoond dat het bereiken van een grotere LDL-c-reductie 6 weken na een acuut myocardinfarct gepaard gaat met een lager risico op algemeen én op cardiovasculair overlijden (75 vs. 15 mg/dL LDL-c-reductie, HR 0,77 [95 % BI 0,70-0,84]).5
Hierbij wordt het 'treat to target'-principe gehanteerd, waarbij wordt gekeken naar de LDL-verlagende capaciteit van elke behandelingsoptie (figuur 1). Hiervoor werden een aantal praktische flowcharts gepubliceerd.6, 7

Deze strategie wordt echter als te complex ervaren voor gebruik in de klinische praktijk. Een simpelere aanpak berust op de opstart van combinatietherapie van een statine én ezetimibe.8-10 Deze combinatietherapie als eerstelijnsbehandeling voor alle patiënten, ongeacht de LDL-c-waarde, geeft de grootste daling in LDL-c na 6 weken, krijgt daarmee meer patiënten op hun targetwaarde en vermijdt onnodige en tijdrovende stappen voor verdere optimalisatie. Daarbij moet worden benadrukt dat een 'te laag' LDL-c niet bestaat. Klinische studies met statines, ezetimibe en PCSK9-inhibitoren hebben aangetoond dat er een log-lineaire relatie is tussen LDL-c-levels en het aantal klinische events zonder plateau, m.a.w. 'lager is beter'. Wat betreft veiligheid kan men enkel een mogelijke associatie met een verhoogd risico op diabetes aanhalen, al houdt dit verband met statines op zich en dus niet met een laag LDL-c. Een LDL-c < 30 mg/dl vormt met andere woorden géén gevaar voor de patiënt én verlaagt het cardiovasculaire risico van de patiënt. Tot slot worden nog twee studies aangehaald die aantonen dat een combinatiepil de therapietrouw bevordert en er hierdoor met de combinatiepil minder klinische events optreden ten opzichte van een behandeling met de afzonderlijke medicamenten.11, 12
De behandelopties zijn uiteraard niet beperkt tot enkel statines en ezetimibe. In geval van een slechte tolerantie of onvoldoende werkzaamheid kan het toevoegen van bempedoïnezuur, een PCSK9-inhibitor of inclisiran (siRNA) een optie zijn. Hierover zijn nog niet veel data voorhanden, maar er werd wel al aangetoond dat PCSK9-inhibitoren een grotere absolute risicoreductie geven wanneer deze in een vroeg stadium opgestart na een hartinfarct worden gegeven.13
Specificities of dyslipidemia management in diabetic patients
Alberto Zambon - Padua, Italië
Het onderwerp van de tweede presentatie is de aanpak van dyslipidemie, specifiek bij patiënten met diabetes. Diabetische dyslipidemie, een belangrijke risicofactor voor macrovasculair lijden bij deze patiënten, is een cluster van lipoproteïne- afwijkingen14 met naast een verhoogd LDL-c en een laag HDL-c ook een hogere spiegel van zowel nuchtere als postprandiale triglyceriden (TG). Ondanks het complexe fenotype blijft LDL-c aangehaald worden als het belangrijkste lipidendoelwit.
De meerderheid van de diabetici, zelfs zonder ASHVZ, behoort tot de hoogof zeerhoogrisicogroep.2 Volgens deze risicostratificatie hebben bijna al onze diabetespatiënten een reductie van het LDL-cholesterol van minimaal 50 % nodig. Daarbovenop moet bij een hoogrisicopatiënt ook een absolute waarde van ≤ 70 mg/dl of bij een zeerhoogrisicopatiënt zelfs ≤ 55 mg/dl worden bereikt.
De literatuur suggereert dat het effect van LDL-verlaging op het aantal majeure coronaire events bij patiënten met diabetes vergelijkbaar is aan deze bij de algemene bevolking.15, 16 Het blijkt echter dat diabeten, zelfs al worden ze behandeld met een statine, nog steeds meer CVE hebben dan niet-diabeten zonder therapie. Daarnaast blijkt dat het toevoegen van ezetimibe aan een statine een sterkere risicoreductie geeft bij diabetici dan in de gewone populatie.9, 17 Aangezien beide groepen (statine ± ezetimibe) een gelijkaardige LDL-c-reductie bereikten9, kan de reductie in LDL-c niet de enige verklaring zijn voor de grotere efficiëntie van ezetimibe bij diabeten.
Er is de laatste jaren voldoende robuust bewijs voor een causaal verband tussen zowel nuchtere als postprandiale triglyceridenrijke lipoproteïnen (TRL) en de 'remnants' enerzijds en CVE anderzijds. Net zoals LDL-c zorgen zij voor schuimcelvorming en plaqueprogressie.18 Daarnaast zijn deze remnants pro-inflammatoir en moduleren ze bloedplaatjesaggregatie. Patiënten met diabetes blijken na een maaltijd een grotere en langdurigere toename van TRL en remnants te hebben.19 Aangezien de mens zich het merendeel van de dag in een postprandiale (niet-nuchtere) fase bevindt, worden diabeten dus voor een langere periode blootgesteld aan dit atherogene lipoproteïne. Toediening van ezetimibe resulteert in een lagere postprandiale lipemie, met name TRL, wat de verhoogde efficiëntie zou kunnen verklaren.
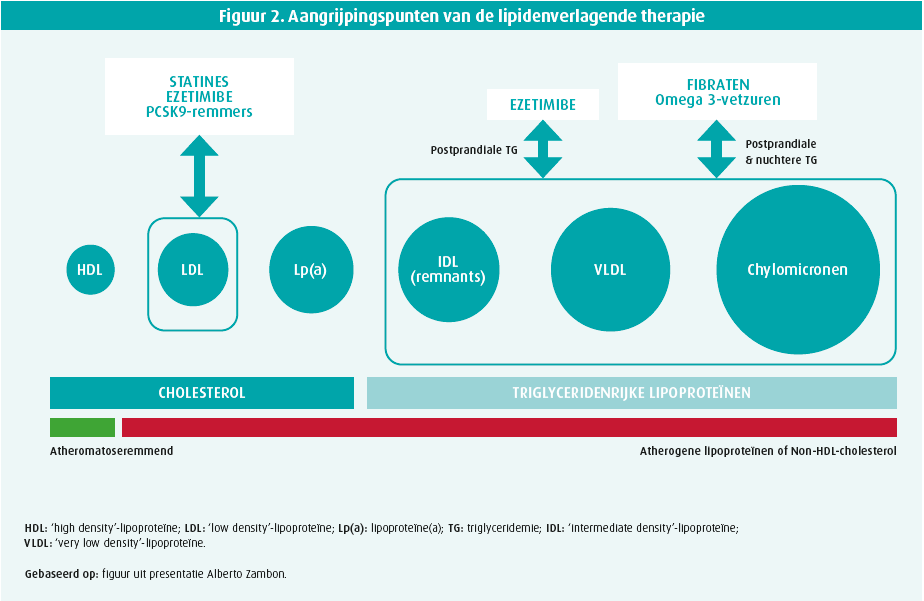
Nuchtere triglyceriden zijn echter even atherogeen en helaas hebben noch statines noch ezetimibe hier een significant effect (figuur 2). De behandeling van nuchtere hypertriglyceridemie omvat combinatietherapie van een statine met een fibraat (ESC-klasse IIb-aanbeveling) of met icosapent ethyl (ESC-klasse IIb-aanbeveling).2
Nadien werd de flowchart van Ray et al.8 getoond (figuur 3 - links), die suggereert dat patiënten met een zeer hoog en extreem hoog risico onmiddellijk combinatietherapie zouden moeten krijgen, aangevuld door een PCSK9-inhibitor indien nodig. Alberto Zambon heeft deze flowchart eigenhandig aangevuld met de groep 'hoog- en zeerhoogrisicodiabeten' (figuur 3 - rechts), bij wie ook onmiddellijk voor een combinatietherapie gekozen wordt met nadien toevoeging van een PCSK9-remmer als de LDL-c-doelstelling niet wordt bereikt.
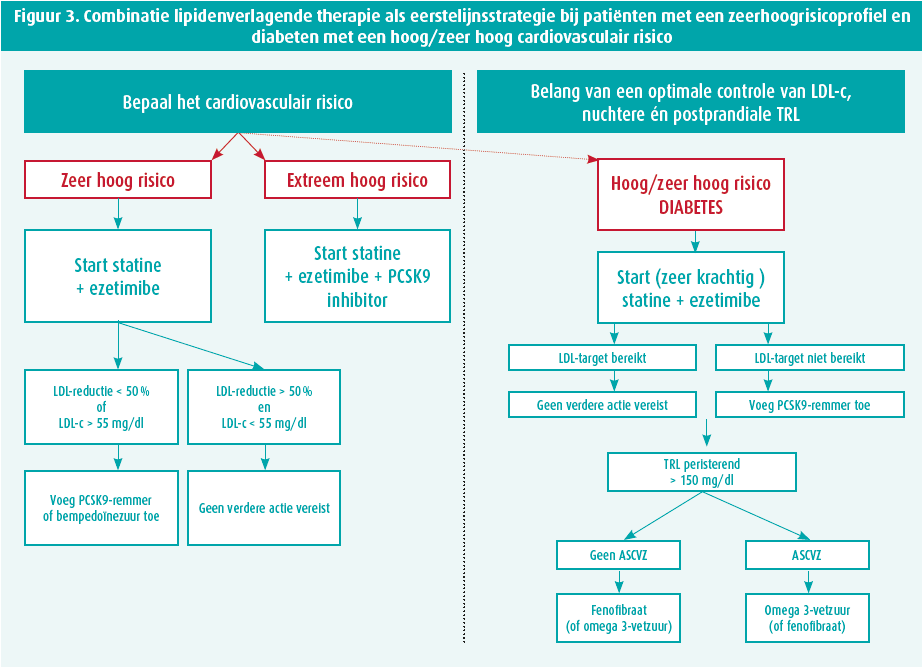
Het stopt echter niet bij LDL-c alleen. Bij diabeten is een optimale controle van zowel LDL-c als TRL, nuchter en postprandiaal, belangrijk voor een effectieve aanpak van CVE. Eens het LDL-c onder controle is, dient je oog te gaan naar de triglyceriden. Als de triglyceridemie persisterend verhoogd blijft, zijn er twee aanvullende behandelingsopties: bij aanwezigheid van ASHVZ opteert Alberto Zambon voor een omega 3-vetzuur. Zo niet, gaat zijn voorkeur uit naar fenofibraat. Uiteraard geldt dit niet enkel voor diabeten, maar ook voor de algemene populatie. De ESC-richtlijnen2 bevelen eveneens een fibraat of omega 3-vetzuur aan in geval van persisterende hypertrygliceridemie bij patiënten die al onder een statine staan: fenofibraat bij TG > 200 mg/dl of icosapent ethyl bij TG > 135 mg/dl.
Besluit
Aan het einde van de presentatie worden de kernboodschappen van beide sessies mooi samengevat door Alberto Zambon: de huidige richtlijnen bevelen nog een stapsgewijze behandeling aan. Beide sprekers zijn er echter van overtuigd dat dit niet voldoende werkt. Zij promoten een vroege combinatietherapie van een statine met ezetimibe als eerstelijnstherapie bij patiënten met een zeerhoogrisicoprofiel, na een myocardinfarct en bij diabeten. Het is eenvoudig te implementeren, is veilig en is beschikbaar in een combinatiepil, wat de therapietrouw bevordert.
Referenties
- Task Force, M., E.S.C.N.C. Societies, and E.S.C.C.f.P. Guidelines. 2019 ESC/ EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis, 2020, 290, 80-82.
- Visseren, F.L.J., Mach, F., Smulders, Y.M., Carballo, D., Koskinas, K.C., Bäck, M. et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J, 2021, 42 (34), 3227-3337.
- Ray, K.K., Molemans, B., Schoonen, W.M., Giovas, P., Bray, S., Kiru, G. et al. EU-Wide Cross-Sectional Observational Study of Lipid- Modifying Therapy Use in Secondary and Primary Care: the DA VINCI study. Eur J Prev Cardiol, 2021, 28 (11), 1279-1289.
- De Backer, G., Jankowski, P., Kotseva, K., Mirrakhimov, E., Reiner, Z., Rydén, L. et al. Management of dyslipidaemia in patients with coronary heart disease: Results from the ESC-EORP EUROASPIRE V survey in 27 countries. Atherosclerosis, 2019, 285, 135-146.
- Schubert, J., Lindahl, B., Melhus, H., Renlund, H., Leosdottir, M., Yari, A. et al. Low-density lipoprotein cholesterol reduction and statin intensity in myocardial infarction patients and major adverse outcomes: a Swedish nationwide cohort study. Eur Heart J, 2021, 42 (3), 243-252.
- Averna, M., Banach, M., Bruckert, E., Drexel, H., Farnier, M., Gaita, D. et al. Practical guidance for combination lipid-modifying therapy in high- and very-high-risk patients: A statement from a European Atherosclerosis Society Task Force. Atherosclerosis, 2021, 325, 99-109.
- Schiele, F., Farnier, M., Krempf, M., Bruckert, E., Ferrières, J. et al. A consensus statement on lipid management after acute coronary syndrome. Eur Heart J Acute Cardiovasc Care, 2018, 7 (6), 532-543.
- Ray, K.K., Reeskamp, L.F., Laufs, U., Banach, M., Mach, F., Tokgözoglu, L.S. et al. Combination lipid-lowering therapy as firstline strategy in very high-risk patients. Eur Heart J, 2022, 43 (8), 830-833.
- Cannon, C.P., Blazing, M.A., Giugliano, R.P., McCagg, A., White, J.A., Theroux, P. et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med, 2015, 372 (25), 2387-2397.
- Hagiwara, N., Kawada-Watanabe, E., Koyanagi, R., Arashi, H., Yamaguchi, J., Nakao, K. et al. Low-density lipoprotein cholesterol targeting with pitavastatin + ezetimibe for patients with acute coronary syndrome and dyslipidaemia: the HIJ-PROPER study, a prospective, open-label, randomized trial. Eur Heart J, 2017, 38 (29), 2264-2276.
- Kim, B.K., Hong, S.J., Lee, Y-J., Jon, S.J., Yun, K.H., Hon, B-K. et al. Long-term efficacy and safety of moderate-intensity statin with ezetimibe combination therapy versus highintensity statin monotherapy in patients with atherosclerotic cardiovascular disease (RACING): a randomised, open-label, noninferiority trial. The Lancet, 2022, 400 (10349), 380-390.
- Castellano, J.M., Pocock, S.J., Bhatt, D.L., Quesada, A.J., Owen, R., Fernandez-Ortiz, A. et al. Polypill Strategy in Secondary Cardiovascular Prevention. N Engl J Med, 2022, 387 (11), 967-977.
- Gencer, B., Mach, F., Murphy, S.A., De Ferrari, G.M., Huber, K., Lewis, B.S. et al. Efficacy of Evolocumab on Cardiovascular Outcomes in Patients With Recent Myocardial Infarction: A Prespecified Secondary Analysis From the FOURIER Trial. JAMA Cardiol, 2020, 5 (8), 952-957.
- Mach, F., Baigent, C., Catapano, A.L., Koskinas, K.C., Casula, M., Badimon, L. et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J, 2020, 41 (1), 111-188.
- Baigent, C., Keech, A., Blackwell, L., Buck, G., Pollicino, C., Kirby, A. et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. The Lancet, 2005, 366 (9493), 1267-1278.
- Cholesterol Treatment Trialists, C., Kearney, P.M., Blackwell, L., Collins, R., Keech, A., Simes, J. et al. Efficacy of cholesterollowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. The Lancet, 2008, 371 (9607), 117-125.
- Hong, N., Lee, Y.H., Tsujita, K., Gonzalez, J.A., Kramer, C.M., Kovarnik, T. et al. Comparison of the Effects of Ezetimibe-Statin Combination Therapy on Major Adverse Cardiovascular Events in Patients with and without Diabetes: A Meta-Analysis. Endocrinol Metab (Seoul), 2018, 33 (2), 219-227.
- Ginsberg, H.N., Packard, C.J., Chapman, M.J., Borén, J., Aguilar-Salinas, C.A., Averna, M. et al. Triglyceride-rich lipoproteins and their remnants: metabolic insights, role in atherosclerotic cardiovascular disease, and emerging therapeutic strategies-a consensus statement from the European Atherosclerosis Society. Eur Heart J, 2021, 42 (47), 4791-4806.
- Tentolouris, N., Stylianou, A., Lourida, E., Perrea, D., Kyriaki, D., Papavasiliou, E.C. et al. High postprandial triglyceridemia in patients with type 2 diabetes and microalbuminuria. J Lipid Res, 2007, 48 (1), 218-225.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.