Technologische vooruitgang is alomtegenwoordig in het dagelijkse leven, maar ook in de klinische praktijk. Zo dragen steeds meer patiënten allerhande accessoires met verschillende ingebouwde sensoren, zogenoemde smart-wearables of kortweg wearables (figuur 1). Hierdoor komt een grote hoeveelheid nieuwe en betrouwbare informatie ter beschikking van de behandelende arts. Naar schatting draagt 20 % van de Amerikaanse bevolking op dit moment al een wearable en het marktaandeel zal naar schatting jaarlijks verder met 25 % toenemen tot een totale omvang van ongeveer 27,5 miljard dollar in 2025.1 Daarnaast willen steeds meer mensen hun gezondheidsdata actief gebruiken bij ziektepreventie. Aangezien deze toepassingen bovendien steeds goedkoper en betrouwbaarder zullen worden, zal elke clinicus hiermee in aanraking komen. Het is daarom van belang basiskennis te hebben over de beschikbare technologieën en de brede waaier aan klinische implicaties. Dit verslag tracht hiervan een samenvatting te geven en is gebaseerd op enkele recent gepubliceerde reviews.1-3
Werkingsprincipes van draagbare sensoren
De term wearables omvat een breed scala aan technologieën (o.a. horloges, brillen, hoorapparaten, kledij, juwelen en tatoeages) met ingebouwde sensoren die continu verschillende gezondheidsparameters kunnen meten. In de volgende paragraaf worden de meest courante sensoren kort toegelicht (figuur 2).
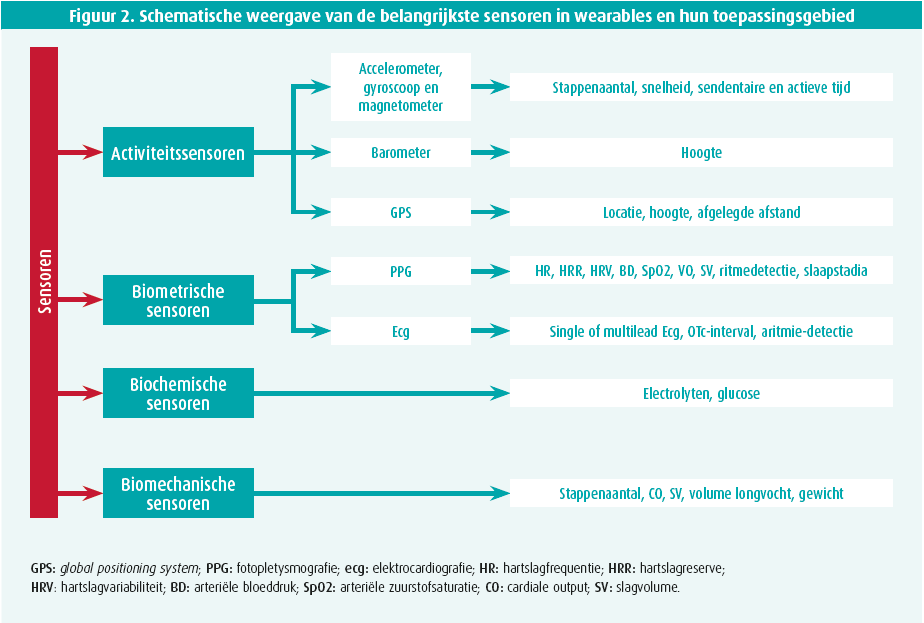
Activiteitsensoren
Fysieke activiteit is omgekeerd gecorreleerd met het ontstaan van cardiovasculaire aandoeningen en mortaliteit van alle oorzaak.4 De inschatting van de fysieke activiteit van een patiënt moest lang worden gebaseerd op de anamnese, wat in veel gevallen geen correcte of op zijn minst een onvolledige weergave was van de werkelijkheid. Deze subjectieve anamnese zal in toenemende mate vervangen kunnen worden door objectieve data zoals intensiteit, afstand en duur van fysieke inspanning, alsook duur van sedentarisme. Hiertoe kunnen verschillende ingebouwde sensoren informatie aanleveren. Enerzijds is er de axiale accelerometer, wat op dit moment de dominante manier is om lineaire acceleratie in de drie assen te registreren. Daartegenover registreert een gyroscoop hoekbewegingen. Om activiteit en positie van de patiënt nog beter in te schatten is er vaak ook een Global Positioning System (GPS) en barometer geïncludeerd in de huidige wearables. Deze sensoren zijn bovendien in toenemende mate energiezuinig en accuraat, waardoor ze in kleine toestellen geïnstalleerd kunnen worden. Het is wel van belang te weten dat de locatie van deze sensoren op het lichaam van de patiënt een van de belangrijkste factoren is die de accuraatheid van de gegevens bepaalt.5 Plaatsing centraal op de torso van de patiënt is het best geschikt om houding, acceleratie en beweging van het volledige lichaam correct te registreren, daar waar een sensor ter hoogte van de enkels beter geschikt is om stappen te registreren.5 Deze laatste is globaal vervangen door plaatsing ter hoogte van de pols vanwege gebruiksgemak.6
Hartslagsensoren
Gegevens omtrent hartslag en hartslagvariabiliteit kunnen helpen cardiovasculaire aandoeningen te voorspellen. Bij gezonde individuen, maar ook bij patiënten met hartfalen, bleek een verhoogde rustpols en verlaagde hartslagvariabiliteit gecorreleerd te zijn met een verhoogd risico op coronairlijden en sterfte van alle oorzaak.7-9 Commerciële wearables maken voornamelijk gebruik van twee methodes om deze parameters te meten: ecg en fotopletysmografie (PPG). Uiteraard is ecg de gouden standaard om het hartritme te meten. Hiervoor zijn verschillende opties beschikbaar. Enerzijds kan men een borstband of klever op de romp dragen. Deze methoden maken continue hartritmemonitoring mogelijk, maar zijn weinig geschikt voor dagdagelijks gebruik gezien het beperkte gebruiksgemak. Recenter kunnen sommige horloges een ecg van 1 afleiding produceren, waarbij de achterkant van het horloge werkt als positieve elektrode en het plaatsen van de contralaterale vinger op de kroon/zijknop als negatieve elektrode. Dit is zeer gebruiksvriendelijk en bruikbaar om basale hartritmeparameters te verkrijgen en om simpele ritmestoornissen, zoals voorkamerfibrillatie, te detecteren, maar onvoldoende om complexe ritmestoornissen of repolarisatiestoornissen te evalueren.10 PPG daarentegen meet pulsgolven als surrogaat voor de hartslag. Deze ontstaan door veranderingen in het microvasculaire bloedvolume ter hoogte van de arteriolen van het subcutaan vaatbed en worden gemeten door continu fotonen door de huid te sturen en de intensiteit van de gereflecteerde fotonen te analyseren. De meeste toestellen activeren de PPG-sensor continu tijdens inspanning, maar slechts periodiek tijdens rust om op die manier de levensduur van de batterij te verlengen. Naast hartslaggegevens kunnen door middel van deze techniek ook arteriële saturatie, ademhalingsfrequentie en slaapparameters worden bekomen.11 Het grootste nadeel van PPG is dat direct huidcontact noodzakelijk is (moeilijk bij horloges) en dat ook huidskleur en tatoeages verkeerde metingen kunnen produceren.1,2 Studies die de accuraatheid van PPG-gebaseerde hartslagmeting ter hoogte van de pols hebben onderzocht bij inspanning tonen zo in 5 % van de gemeten tijd inaccurate meting.12 Hartslaggegevens gemeten met behulp van PPG moeten dus met enige voorzorg worden geïnterpreteerd, hoewel de accuraatheid in de toekomst zeker kan toenemen - zeker indien de bekomen gegevens worden geïntegreerd met machine learning en artificiële intelligentie.1
Bloeddruksensoren
Arteriële hypertensie is een van de grootste oorzaken van morbiditeit en mortaliteit wereldwijd. Het adequaat meten van de bloeddruk door middel van wearables kan dan ook tot voordeel hebben meer mensen vroegtijdig met de aandoening te diagnosticeren en tevens patiëntengroepen te identificeren met geïsoleerde nachtelijke en/of inspanningsgebonden arteriële hypertensie, wat beiden een ongunstige cardiovasculaire prognose met zich meedraagt.13 Ambulante bloeddrukmeting gebeurt nu klassiek met een opblaasbare manchet. In sommige wearables is een manchetloze meting van de bloeddruk mogelijk, wat het gebruiksgemak voor de patiënt bevordert. Deze technologie maakt gebruik van een combinatie van ecg en PPG door het berekenen van de transittijd van de arteriële pulsgolf van het hart (QRS-complex van het ecg) tot aan het perifeer bloedvat (pulsgolf gemeten d.m.v. PPG). De accuraatheid van deze metingen in vergelijking met sfygmomanometrie is eerder matig, en de beschikbare studies zijn bovendien veelal kleinschalig met weinig diversiteit in de geïncludeerde populatie.14 Hoewel de techniek dus veelbelovend is, is verdere optimalisatie en grootschalig onderzoek noodzakelijk om de accuraatheid en validiteit van deze metingen te verbeteren.15
Andere sensoren
Biochemische sensoren kunnen een chemisch of biologisch substraat omzetten in een elektrisch signaal. Ook deze sensoren kunnen in wearables worden geïncorporeerd om bijvoorbeeld informatie te verschaffen over elektrolytconcentraties en plasmavolume.16 Het bekendste voorbeeld hierbij is de minimaal invasieve glucosemonitor bij patiënten met diabetes, hoewel dit tot op heden nog niet geïncorporeerd is in een wearable, maar eerder als alleenstaand product verkocht wordt. De accuraatheid van biochemische sensoren is nog sterk afhankelijk van huidtemperatuur, bevuiling door stof of gedroogd zweet en door lichaamsbeharing. Verder onderzoek is dan ook nodig om deze beperkingen weg te werken. Daarnaast zijn er ook biomechanische sensoren in ontwikkeling om bijvoorbeeld in kleding of schoenen aan te brengen, of op de huid als een soort tatoeage, en continu variabelen zoals gewicht, longvocht en cardiale output te kunnen meten.17 Al deze types sensoren staan nog in de kinderschoenen en hebben nog uitgebreide externe validatie nodig vooraleer ze in de klinische praktijk bruikbaar zullen zijn.
Gebruik van wearables in de dagelijkse praktijk
Volgende paragraaf beschrijft enkele toepassingsgebieden binnen de cardiale dagelijkse praktijk waar wearables in de toekomst verandering kunnen brengen.
Risico-analyse en levenstijlinterventies
Klassiek wordt het cardiale risico van een patiënt ingeschat op basis van zijn tienjaarsrisico op cardiovasculaire sterfte. Veel van deze scores houden echter geen rekening met dynamische parameters, voornamelijk omdat het bekomen van objectieve data hieromtrent niet eenvoudig is. De komst van de wearables kan deze risicoschatting meer dynamisch en accuraat maken. Zo hebben verschillende studies reeds aangetoond dat fysieke activiteit die door middel van wearables is gemeten omgekeerd gecorreleerd is met sterfte van alle oorzaak.18-20 In de toekomst kunnen dus nieuwe risicoscores worden ontwikkeld waarin fysieke activiteit, maar ook parameters zoals rustpols en hartslagvariabiliteit worden geïncorporeerd. Daarnaast kunnen de data van wearables ook worden gekoppeld aan specifieke gedragstherapieën. Zo toonde een studie uit 2015 reeds het voordeel van motivationele boodschappen op een smartwatch. Men zag namelijk dat patiënten die dergelijke boodschappen ontvingen, significant meer stappen per dag zetten dan patiënten bij wie geen boodschappen verschenen.21 Ook het ontwikkelen van spelgebaseerde competitie tussen leden van een specifiek netwerk (bijvoorbeeld van een cardiaal revalidatieprogramma) kan tot activatie leiden. In studies over deze vorm van gedragstherapie zag men namelijk ook een significante stijging in het dagelijks aantal stappen tegenover baselinewaarden en in vergelijking met een controlegroep.22 Het bemoedigen van fysieke activiteit is een hoeksteen in de primaire en secundaire preventie van cardiovasculaire aandoeningen en voorgaande toepassingen kunnen hier in de toekomst vooruitgang in bieden.
Screening en diagnose
Hypertensie
Screening naar arteriële hypertensie op jongvolwassen leeftijd is aanbevolen om cardiovasculaire aandoeningen te voorkomen.13 Bij verdere optimalisatie van de metingen kunnen manchetloze wearables in de toekomst worden ingezet in de screening voor arteriële hypertensie, de opvolging van behandeling en de titratie van geneesmiddelen, en dit met een groter gebruiksgemak dan de klassieke bloeddrukmeters met manchet.23 Ook diverse types arteriële hypertensie (e.g. solitair nachtelijk of inspanningsgebonden) zullen accurater kunnen worden gediagnosticeerd. Grootschalig onderzoek voor deze indicaties ontbreekt echter nog.
Voorkamerfibrillatie
Gezien de vergrijzing van de populatie wordt VKF steeds meer een endemische entiteit.1 Wearables kunnen helpen in de diagnose van zowel asymptomatische als symptomatische VKF.1 Zo onderzocht de Apple Heart Study bij 419 297 patiënten of een PPG-gebaseerd toestel VKF kon diagnosticeren bij patiënten zonder voorgeschiedenis van deze aandoening en bleek de positief voorspellende waarde voor VKF-detectie bij het detecteren van een onregelmatige pols 84 %. De combinatie van de Apple Watch PPG-sensor en een diepneuraalnetwerk-algoritme bleek bovendien tot een zeer goeie voorspelling voor VKF te leiden in vergelijking met een standaard 12 afleidingen-ecg.24 Op dit moment loopt de HEARTLINE-trial, wat de eerste gerandomiseerde studie is die onderzoekt of detectie van VKF met een Apple Watch al dan niet leidt tot een verbeterde uitkomst voor de patiënt.
Ook andere hartritmestoornissen zullen in toenemende mate gediagnosticeerd kunnen worden met wearables en dit zal de nood tot het dragen van logge holtersystemen waarschijnlijk reduceren. Zo toonde een multicentrische studie bij 243 patiënten die zich op dienst Spoedgevallen hadden aangemeld vanwege palpitaties en presyncope een betere en snellere diagnostische opbrengst aan bij het gebruik van een kleine en mobiele ecg-meter in vergelijking met routinezorg na 3 maanden (detectie van een symptomatisch hartritme bij 55,6 % vs. 9,5 % van de patiënten en na gemiddeld 9 dagen vs. 43 dagen).25
Andere toepassingen
Verdere integratie van bekomen data uit wearables met artificiële intelligentie opent nog meer mogelijkheden. Zo bleek een semi-gesuperviseerd algoritme in staat om bij patiënten tamelijk correct een afwijkend lipidogram en arteriële bloeddruk te kunnen voorspellen op basis van hartslag- en stapgegevens van wearables (AUC respectievelijk 0,74 en 0,80).26 In een andere studie kon een algoritme met goede accuraatheid ventriculaire disfunctie voorspellen op basis van een ecg.27 Patiënten met een valspositief resultaat bleken in opvolging bovendien een viervoudig risico te hebben om alsnog ventriculaire disfunctie te ontwikkelen. Indien dergelijke algoritmes gevalideerd kunnen worden voor ecg's met één afleiding, kunnen deze potentieel worden geïncorporeerd in wearables.
Behandeling
Het potentieel gebruik van wearables in de behandeling van cardiale aandoeningen kan zeer breed zijn. Onderstaand worden vier voorbeelden beschreven waarin hun gebruik mogelijk een voordeel kan bieden.
Acuut coronair syndroom
Eénafleidings-ecg's en PPG-gebaseerde ecg's worden klassiek gebruikt voor de detectie van ritmestoornissen en zijn niet geschikt voor de diagnose van een ST-elevatiemyocardinfarct (STEMI) aangezien elke vorm van ischemie buiten het anatomische detectieterrein van de ene afleiding niet gedetecteerd zal worden. Mocht de accuraatheid van een wearable echter dermate hoog worden dat een correct ecg met 12 afleidingen wordt bekomen, zou dit kunnen leiden tot reductie in kost, tijd en gebruik van medisch personeel terwijl de diagnostische opbrengst zou stijgen.28 Daarom werden reeds enkele studies uitgevoerd om precordiale afleidingen te reproduceren met o.a. de Apple Watch door het toestel sequentieel op verschillende plaatsen van de borstkas te houden, wat accuraat blijkt te zijn indien correct toegepast, maar weinig gebruiksvriendelijk is voor de individuele patiënt.28 Verder onderzoek is dan ook nodig om op eenvoudigere wijze een volledig ecg te reproduceren.
Hartfalen
Patiënten gehospitaliseerd vanwege gedecompenseerd hartfalen zullen in 25 % van de gevallen binnen de maand opnieuw worden gehospitaliseerd, wat gepaard gaat met een stijging in mortaliteit en kosten voor de gezondheidszorg.29,30 Het is dus van belang hospitalisatie te voorkomen bij hartfalenpatiënten door vroegtijdige detectie van inzettende decompensatie. In de MULTISENSE-trial kon men hartfalenevents tijdig voorspellen op basis van een algoritme gebaseerd op gegevens uit geïmplanteerde toestellen. 31 Ook het voordeel van telemonitoring door middel van wearables op harde eindpunten bij deze patiënten is reeds onderzocht in verschillende trials, maar met verschillende resultaten. Zo toonde de TIM-HF2-trial een lagere sterfte van alle oorzaak bij patiënten met symptomatisch hartfalen (NYHA II-III) met gereduceerde ejectiefractie die op afstand werden gevolgd door middel van een ecg, bloeddrukmeter, saturatiemeter en weegschaal en dit in vergelijking tot patiënten die de standaardzorg ontvingen.32 Daarentegen konden gelijkaardige trials zoals de TEN-HMS-trial en de TIM-HF-trial geen verschil aantonen.33,34 Een reden hiervoor kan zijn dat het gunstige effect van telemonitoring ook louter toegeschreven kan worden aan de intensievere opvolging van deze patiëntengroep en niet noodzakelijk aan het gebruik van wearables an sich.35 Deze studies kunnen bovendien onderling moeilijk worden vergeleken gezien de verschillende in- en exclusiecriteria, evenals verschillende types sensoren. Grootschaliger onderzoek met een standaard protocol is dus noodzakelijk om het nut van wearables in de opvolging van hartfalenpatienten beter te kunnen definiëren.3 Daarnaast kunnen wearables in de toekomst ook hulp bieden in de detectie van nieuw hartfalen in de algemene bevolking. Zo bleek uit een kleinere pilootstudie uit 2020 dat PPG- en accelerometergebaseerde gegevens van een polsband gedecompenseerd hartfalen in 74 % van de patiënten correct kon voorspellen.36
Gekende VKF
Een continue meting van het hartritme kan de mogelijkheid bieden om de hedendaagse categorische definitie van VKF (e.g. paroxysmaal, persistent, permanent) te veranderen naar een meer kwantificeerbare vorm met potentieel nieuwe indicaties voor anticoagulatie en/ of ritmecontrole.3 Zo zou men kunnen overwegen om anticoagulatie enkel in te nemen indien VKF aanwezig is. Zo toonde de REACT.COM-trial een reductie van 94 % in het gebruik van anticoagulatie indien patiënten met een geïmplanteerde ritmemonitor slechts anticoagulatie innamen tijdens een episode van VKF die > 1 uur aanhield.37 De veiligheid van een dergelijke techniek werd in het verleden reeds bevestigd,38 hoewel verder onderzoek nodig blijft met focus op beroerterisico en therapietrouw. Naast voorgaande toepassing kan een wearable ook helpen om spontane resinusalisatie vast te stellen bij patiënten die gepland staan voor electieve cardioversie, wat onnodige opnames en kosten kan voorkomen.39 Verder kunnen wearables hun nut hebben bij patiënten met een permanente VKF voor verdere optimalisatie van de ventriculaire respons in rust en bij inspanning.40
Cardiale revalidatie
Cardiale revalidatie is belangrijk in de behandeling van verschillende cardiovasculaire aandoeningen gezien het gestructureerde oefenprogramma's combineert met focus op secundaire risicopreventie. Telerevalidatie gebaseerd op realtime data van wearables zou de manier waarop revalidatieprogramma's worden uitgevoerd kunnen veranderen. Zo zou de participatiegraad kunnen worden verhoogd indien kwalitatieve thuisrevalidatie mogelijk is. In dit kader toonde een grote meta-analyse bij 2 890 patiënten reeds aan dat cardiale revalidatie van thuis uit even effectief kan zijn als gecentraliseerde revalidatieprogramma's.41 Een andere meta-analyse toonde aan dat wearables met oefenadvies de fitheid en het stappenaantal van cardiaal belaste patiënten verhoogde in de onderhoudsfase van hun cardiale revalidatietraject.42 Ook hier blijft grootschalig en gerandomiseerd onderzoek nodig om de rol van wearables in cardiale revalidatie verder te definiëren.
Conclusie
Wearables zijn stilaan niet meer uit het dagelijkse leven weg te denken en de hoeveelheid nieuwe informatie die hiermee tot onze beschikking komt is uitgebreid. Het valt te verwachten dat deze toestellen in de toekomst nog performanter zullen worden in het meten van complexere processen en ook verder deel zullen uitmaken van de dagelijkse klinische praktijk. De mogelijkheden die hierdoor ontstaan om de zorg voor de cardiale patiënt te optimaliseren zijn enorm en het is dan ook van alle belang dat de clinicus hiermee vertrouwd raakt.
Referenties
- Dagher, L., Shi, H., Zhao, Y. et al. Wearables in cardiology: Here to stay. Heart Rhythm, 2020, 17, 889-895.
- Kamišalic, A., Fister, I.J., Turkanovic, M. et al. Sensors and Functionalities of Non-Invasive Wrist-Wearable Devices: A Review. Sensors, 2018, 18 (6), 1714.
- Bayoumy, K., Gaber, M., Elshafeey, A. et al. Smart wearable devices in cardiovascular care: where we are and how to move forward. Nat Rev Cardiol, 2021, 18, 581-599.
- Blond, K., Brinkløv, C.F., Ried-Larsen, M. et al. Association of high amounts of physical activity with mortality risk: a systematic review and meta-analysis. Br J Sports Med, 2020, 54, 1195-1201.
- Yang, C-C., Hsu, Y-L. A review of accelerometry-based wearable motion detectors for physical activity monitoring. Sensors, 2010, 10, 7772-7788.
- Troiano, R.P., McClain, J.J., Brychta, R.J. et al. Evolution of accelerometer methods for physical activity research. Br J Sports Med, 2014, 48, 1019-1023.
- Zhang, D., Wang, W., Li, F. Association between resting heart rate and coronary artery disease, stroke, sudden death and noncardiovascular diseases: a meta-analysis. CMAJ, 2016, 188, E384-E392.
- Fox, K., Ford, I., Steg, P.G. et al. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomised controlled trial. The Lancet, 2008, 372, 817-821.
- Singh, N., Moneghetti, K.J., Christle, J.W. et al. Heart Rate Variability: An Old Metric with New Meaning in the Era of Using mHealth technologies for Health and Exercise Training Guidance. Part Two: Prognosis and Training. Arrhythmia Electrophysiol Rev, 2018, 7, 247-255.
- Cobos Gil, M.Á. Standard and Precordial Leads Obtained With an Apple Watch. Ann Intern Med, 2020, 172, 436-437.
- Allen, J. Photoplethysmography and its application in clinical physiological measurement. Physiol Meas, 2007, 28, R1-39.
- Etiwy, M., Akhrass, Z., Gillinov, L. et al. Accuracy of wearable heart rate monitors in cardiac reha bili tation. Cardiovasc Diagn Ther, 2019, 9, 262-271.
- Whelton, P.K., Carey, R.M., Aronow, W.S. et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/ APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical P. Hypertension, 2018, 71, e13-e115.
- Muniyandi, M., Sellappan, S., Chellaswamy, V. et al. Diagnostic accuracy of mercurial versus digital blood pressure measurement devices: a systematic review and meta-analysis. Sci Rep, 2022, 12, 3363.
- Elgendi, M., Fletcher, R., Liang, Y. et al. The use of photoplethysmography for assessing hypertension. NPJ Digit Med, 2019, 2, 60.
- Kim, J., Campbell, A.S., de Ávila, BE-F. et al. Wearable biosensors for healthcare monitoring. Nat Biotechnol, 2019, 37, 389-406.
- Sana, F., Isselbacher, E.M., Singh, J.P. et al. Wearable Devices for Ambulatory Cardiac Monitoring: JACC State-of-the-Art Review. J Am Coll Cardiol, 2020, 75, 1582-1592.
- LaMonte, M.J., Buchner, D.M., Rillamas-Sun, E. et al. Accelerometer-Measured Physical Activity and Mortality in Women Aged 63 to 99. J Am Geriatr Soc, 2018, 66, 886-894.
- Borgundvaag, E., Janssen, I. Objectively Measured Physical Activity and Mortality Risk Among American Adults. Am J Prev Med, 2017, 52, e25-e31.
- Dohrn, I-M., Sjöström, M., Kwak, L. et al. Accelerometer-measured sedentary time and physical activity-A 15 year follow-up of mortality in a Swedish population-based cohort. J Sci Med Sport, 2018, 21, 702-707.
- Martin, S.S., Feldman, D.I., Blumenthal, R.S. et al. mActive: A Randomized Clinical Trial of an Automated mHealth Intervention for Physical Activity Promotion. J Am Heart Assoc, 2015, 4 (11), e002239.
- Patel, M.S., Benjamin, E.J., Volpp, K.G. et al. Effect of a Game-Based Intervention Designed to Enhance Social Incentives to Increase Physical Activity Among Families: The BE FIT Randomized Clinical Trial. JAMA Intern Med, 2017, 177, 1586-1593.
- Kuwabara, M., Harada, K., Hishiki, Y. et al. Validation of two watch-type wearable blood pressure monitors according to the ANSI/ AAMI/ISO81060-2:2013 guidelines: Omron HEM-6410T-ZM and HEM-6410T-ZL. J Clin Hypertens, 2019, 21, 853-858.
- Tison, G.H., Sanchez, J.M., Ballinger, B. et al. Passive Detection of Atrial Fibrillation Using a Commercially Available Smartwatch. JAMA Cardiol, 2018, 3, 409-416.
- Reed, M.J., Grubb, N.R., Lang, C.C. et al. Multi-centre Randomised Controlled Trial of a Smartphone-based Event Recorder Alongside Standard Care Versus Standard Care for Patients Presenting to the Emergency Department with Palpitations and Pre-syncope: The IPED (Investigation of Palpitations in the ED) study. EClinicalMedicine, 2019, 8, 37-46.
- Ballinger, B., Hsieh, J., Singh, A. et al. DeepHeart: Semi-Supervised Sequence Learning for Cardiovascular Risk Prediction. Proc AAAI Conf Artif Intell, 2018, 32 (1).
- Attia, Z.I., Kapa, S., Lopez-Jimenez, F. et al. Screening for cardiac contractile dysfunction using an artificial intelligence-enabled electrocardiogram. Nat Med, 2019, 25, 70-74.
- Sprenger, N., Sepehri Shamloo, A., Schäfer, J. et al. Feasibility and Reliability of Smartwatch to Obtain Precordial Lead Electrocardiogram Recordings. Sensors, 2022, 22 (3), 1217.
- Ryan, A.M., Nallamothu, B.K., Dimick, J.B. Medicare's public reporting initiative on hospital quality had modest or no impact on mortality from three key conditions. Health Aff, 2012, 31, 585-592.
- Dunlay, S.M., Shah, N.D., Shi, Q. et al. Lifetime costs of medical care after heart failure diagnosis. Circ Cardiovasc Qual Outcomes, 2011, 4, 68-75.
- Boehmer, J.P., Hariharan, R., Devecchi, F.G. et al. A Multisensor Algorithm Predicts Heart Failure Events in Patients With Implanted Devices: Results From the MultiSENSE Study. JACC Heart Fail, 2017, 5, 216-225.
- Koehler, F., Koehler, K., Deckwart, O. et al. Efficacy of telemedical interventional management in patients with heart failure (TIM-HF2): a randomised, controlled, parallel- group, unmasked trial. The Lancet, 2018, 392, 1047-1057.
- Cleland, J.G.F., Louis, A.A., Rigby, A.S. et al. Noninvasive home telemonitoring for patients with heart failure at high risk of recurrent admission and death: the Trans- European Network-Home-Care Management System (TEN-HMS) study. J Am Coll Cardiol, 2005, 45, 1654-1664.
- Koehler, F., Winkler, S., Schieber, M. et al. Impact of remote telemedical management on mortality and hospitalizations in ambulatory patients with chronic heart failure: the telemedical interventional monitoring in heart failure study. Circulation, 2011, 123, 1873-1880.
- Dendale, P., De Keulenaer, G., Troisfontaines, P. et al. Effect of a telemonitoring-facilitated collaboration between general practitioner and heart failure clinic on mortality and rehospitalization rates in severe heart failure: the TEMA-HF 1 (TElemonitoring in the MAnagement of Heart Failure) study. Eur J Heart Fail, 2012, 14, 333-340.
- Shah, A.J., Isakadze, N., Levantsevych, O. et al. Detecting heart failure using wearables: a pilot study. Physiol Meas, 2020, 41, 44001.
- Passman, R., Leong-Sit, P., Andrei, A-C. et al. Targeted Anticoagulation for Atrial Fibrillation Guided by Continuous Rhythm Assessment With an Insertable Cardiac Monitor: The Rhythm Evaluation for Anticoagulation With Continuous Monitoring (REACT.COM) Pilot Study. J Cardiovasc Electrophysiol, 2016, 27, 264-270.
- Zado, E.S., Pammer, M., Parham, T. et al. 'As Needed' nonvitamin K antagonist oral anticoagulants for infrequent atrial fibrillation episodes following atrial fibrillation ablation guided by diligent pulse monitoring: A feasibility study. J Cardiovasc Electrophysiol, 2019, 30, 631-638.
- Bumgarner, J.M., Lambert, C.T., Hussein, A.A. et al. Smartwatch Algorithm for Automated Detection of Atrial Fibrillation. J Am Coll Cardiol, 2018, 71, 2381-2388.
- Elshazly, M.B., Wilkoff, B.L., Tarakji, K. et al. Exercise Ventricular Rates, Cardiopulmonary Exercise Performance, and Mortality in Patients With Heart Failure With Atrial Fibrillation. Circ Heart Fail, 2021, 14, e007451.
- Anderson, L., Sharp, G.A., Norton, R.J. et al. Home-based versus centre-based cardiac rehabilitation. Cochrane database Syst Rev, 2017, 6, CD007130.
- Hannan, A.L., Harders, M.P., Hing, W. et al. Impact of wearable physical activity monitoring devices with exercise prescription or advice in the maintenance phase of cardiac rehabilitation: systematic review and meta-analysis. BMC Sport Sci Med Rehabil, 2019, 11, 14.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.