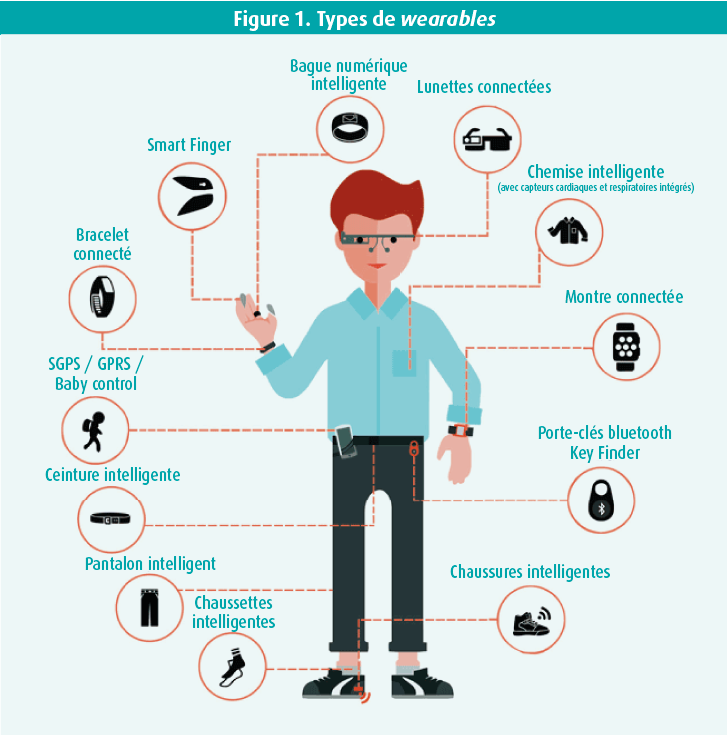
Les progrès technologiques sont omniprésents dans la vie quotidienne, mais aussi en pratique clinique. Ainsi, de plus en plus de patients portent toutes sortes d'accessoires dotés de divers capteurs intégrés, les fameux 'smart-wearables' ou 'wearables', en abrégé (figure 1). De ce fait, le médecin dispose d'un grand nombre d'informations nouvelles et fiables. On estime que 20 % de la population américaine porte déjà un wearable et que la part de marché devraitg encore augmenter de 25 % par an pour atteindre un total d'environ 27,5 milliards de dollars d'ici 2025.1 En outre, de plus en plus de personnes souhaitent utiliser activement leurs données de santé pour prévenir des maladies. Étant donné que ces applications deviendront de plus en plus fiables et accessibles financièrement, tous les cliniciens finiront par y être confrontés. Il est donc important d'avoir des connaissances de base sur les technologies disponibles et le large éventail d'implications cliniques. Cet article tente d'en faire la synthèse, en se basant sur quelques revues publiées récemment.1-3
Principes de fonctionnement des capteurs portables
Le terme wearables couvre un large éventail de technologies (e.a. les montres, lunettes, appareils auditifs, vêtements, bijoux et tatouages) dotées de capteurs intégrés capables de mesurer en continu divers paramètres de santé. Le paragraphe suivant traitera brièvement des capteurs les plus courants (figure 2).
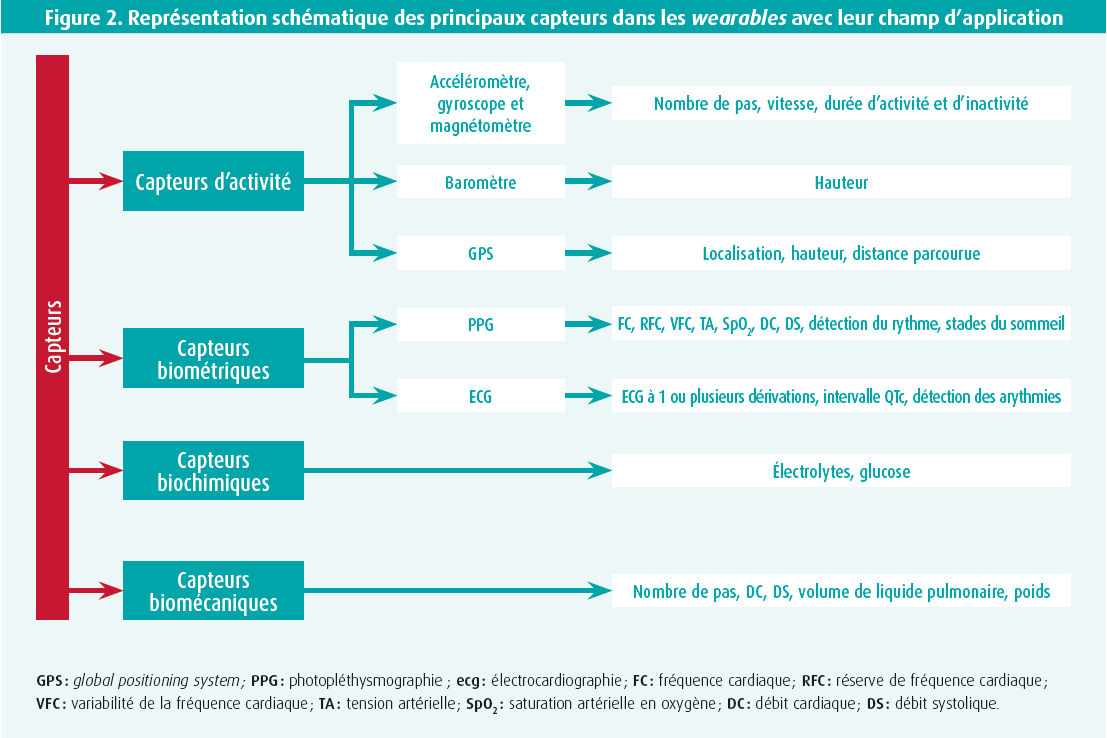
Capteurs d'activité
L'activité physique est inversement corrélée à l'apparition de maladies cardiovasculaires et à la mortalité, quelle qu'en soit la cause.4 Pour estimer l'activité physique d'un patient, on a longtemps dû se baser sur l'anamnèse qui, dans de nombreux cas, était une représentation incorrecte ou du moins incomplète de la réalité. Cette anamnèse subjective pourra de plus en plus être remplacée par des données objectives, telles que l'intensité, la distance parcourue et la durée de l'activité physique, ainsi que la durée d'inactivité. À cette fin, plusieurs capteurs intégrés peuvent fournir des informations. D'une part, il y a l'accéléromètre axial, qui est actuellement le principal moyen d'enregistrer l'accélération linéaire dans les 3 axes. En revanche, un gyroscope enregistre les mouvements angulaires. Pour estimer encore mieux l'activité et la position du patient, un système de positionnement global (GPS) et un baromètre sont souvent inclus dans les wearables actuels. Ces capteurs sont en outre de plus en plus économes en énergie et précis, ce qui permet de les installer dans de petits appareils. Cependant, il est important de noter que le positionnement de ces capteurs sur le corps du patient est un des principaux facteurs qui déterminent la précision des données.5 Un positionnement central sur le torse du patient convient le mieux pour enregistrer correctement la posture, l'accélération et les mouvements du corps entier, alors qu'un capteur au niveau des chevilles est mieux adapté pour enregistrer les pas.5 Ce dernier a largement été remplacé par un placement au niveau du poignet, en raison de sa facilité d'utilisation.6
Capteurs de fréquence cardiaque
Les données relatives à la fréquence cardiaque et à sa variabilité peuvent aider à prédire les maladies cardiovasculaires. Chez les personnes en bonne santé, mais aussi chez les patients souffrant d'insuffisance cardiaque, on a constaté qu'un pouls élevé au repos et une variabilité réduite de la fréquence cardiaque étaient corrélés à un risque accru de maladie coronarienne et de mortalité toutes causes.7-9 Les wearables commerciaux utilisent principalement 2 méthodes pour mesurer ces paramètres : l'ECG et la photopléthysmographie (PPG). Il va de soi que l'ECG est la référence pour mesurer le rythme cardiaque. Pour ce faire, plusieurs options existent. D'une part, on peut porter une ceinture thoracique ou une électrode adhésive sur le tronc. Ces méthodes permettent de surveiller la fréquence cardiaque en continu, mais elles ne sont pas très adaptées à une utilisation quotidienne, en raison de leur difficulté d'emploi. Plus récemment, certaines montres peuvent produire un ECG à 1 dérivation, le dos de la montre servant d'électrode positive et le doigt controlatéral placé sur la couronne/le bouton latéral servant d'électrode négative. Cette méthode est très conviviale et utile pour obtenir les paramètres de base de la fréquence cardiaque et détecter des troubles du rythme simples, comme la fibrillation auriculaire, mais elle est insuffisante pour évaluer des arythmies complexes ou des troubles de la repolarisation.10 La PPG, quant à elle, mesure les ondes de pouls comme substitut de la fréquence cardiaque. Celles-ci résultent des variations du volume sanguin microvasculaire au niveau des artérioles du lit vasculaire sous-cutané et sont mesurées en envoyant en continu des photons à travers la peau et en analysant l'intensité des photons réfléchis. La plupart des appareils activent le capteur PPG en continu lors d'un effort, mais seulement périodiquement au repos, afin de prolonger la durée de vie de la batterie. Outre les données sur la fréquence cardiaque, cette technique permet également de connaître la saturation artérielle, la fréquence respiratoire et les paramètres du sommeil.11 Les principaux inconvénients de la PPG sont qu'un contact direct avec la peau est nécessaire (difficile avec les montres) et que la couleur de la peau et les tatouages peuvent produire des mesures incorrectes.1,2 Les études qui ont examiné la précision de la mesure de la fréquence cardiaque basée sur la PPG au niveau du poignet pendant un effort donnent ainsi des résultats inexacts dans 5 % du temps mesuré.12 Les données de fréquence cardiaque mesurées par PPG doivent donc être interprétées avec une certaine prudence, bien que la précision puisse certainement augmenter à l'avenir - en particulier si les données obtenues sont intégrées à l'apprentissage automatique et à l'intelligence artificielle.1
Capteurs de pression artérielle
L'hypertension artérielle est une des principales causes de morbi-mortalité dans le monde. Une mesure adéquate de la pression artérielle par le biais de wearables pourrait donc avoir l'avantage de diagnostiquer précocement l'affection chez un plus grand nombre de personnes et d'identifier les groupes de patients souffrant d'hypertension artérielle nocturne isolée et/ou liée à l'effort, 2 pathologies dont le pronostic cardiovasculaire est défavorable.13 Actuellement, la mesure ambulatoire de la pression artérielle se fait classiquement à l'aide d'une manchette gonflable. Avec certains wearables, il est possible de mesurer la pression artérielle sans manchette, ce qui est plus convivial pour le patient. Cette technologie utilise une combinaison de l'ECG et de la PPG en calculant le temps de transit de l'onde de pouls artériel du coeur (complexe QRS de l'ECG) jusqu'au vaisseau sanguin périphérique (onde de pouls mesurée par la PPG). La précision de ces mesures par rapport à la sphygmomanométrie est assez limitée, et les études disponibles sont également pour la plupart à petite échelle, avec une faible diversité dans la population incluse.14 Ainsi, bien que la technique soit prometteuse, une optimisation supplémentaire et des études à grande échelle sont nécessaires pour améliorer la précision et la validité de ces mesures.15
Autres capteurs
Les capteurs biochimiques peuvent convertir un substrat chimique ou biologique en un signal électrique. Ces capteurs peuvent également être incorporés dans les wearables pour fournir, par exemple, des informations sur les concentrations d'électrolytes et le volume plasmatique.16 L'exemple le plus connu est le moniteur de glucose mini-invasif pour les patients diabétiques, bien que jusqu'à présent, il ne soit pas encore intégré dans un wearable, mais plutôt vendu comme un produit autonome. La précision des capteurs biochimiques dépend toujours fortement de la température de la peau, de l'encrassement par la poussière ou la sueur séchée et de la pilosité. Des études complémentaires sont donc nécessaires pour vaincre ces obstacles. En outre, des capteurs biomécaniques en cours de développement pourraient par exemple être appliqués dans les vêtements ou les chaussures, ou sur la peau comme une sorte de tatouage, permettant ainsi de mesurer en continu des variables telles que le poids, la quantité de liquide pulmonaire et le débit cardiaque.17 Tous ces types de capteurs en sont encore à leurs balbutiements et doivent faire l'objet d'une validation externe approfondie avant de pouvoir être utilisés en pratique clinique.
Utilisation de wearables en pratique quotidienne
Le paragraphe ci-dessous décrit certains domaines d'application en pratique cardiologique quotidienne, où les wearables pourraient apporter des changements à l'avenir.
Analyse du risque et interventions sur le style de vie
Classiquement, le risque cardiaque d'un patient est évalué sur la base de son risque de mortalité cardiovasculaire à 10 ans. Toutefois, nombre de ces scores ne tiennent pas compte des paramètres dynamiques, principalement parce qu'il n'est pas facile d'obtenir des données objectives à ce sujet. L'avènement des wearables pourrait rendre cette estimation du risque plus dynamique et plus précise. Ainsi, plusieurs études ont déjà montré que l'activité physique mesurée par les wearables est inversement corrélée à la mortalité toutes causes.18-20 De ce fait, à l'avenir, de nouveaux scores de risque pourront être développés en intégrant non seulement l'activité physique, mais aussi des paramètres tels que le pouls au repos et la variabilité de la fréquence cardiaque. En outre, les données provenant des wearables peuvent également être couplées à des thérapies comportementales spécifiques. Ainsi, une étude de 2015 montrait déjà le bénéfice des messages de motivation sur une montre connectée. En effet, on a constaté que les patients qui recevaient de tels messages faisaient beaucoup plus de pas par jour que les patients qui ne recevaient aucun message.21 Le développement d'une compétition ludique entre les membres d'un réseau spécifique (par exemple d'un programme de revalidation cardiaque) peut également être motivant. En effet, les études sur cette forme de thérapie comportementale ont également constaté une augmentation significative du nombre de pas quotidiens par rapport aux valeurs initiales et par rapport à un groupe témoin.22 La promotion de l'activité physique est une pierre angulaire de la prévention primaire et secondaire des maladies cardiovasculaires, et les applications précédentes pourraient être synonymes de progrès.
Dépistage et diagnostic
Hypertension
Le dépistage de l'hypertension artérielle chez les adultes jeunes est recommandé pour prévenir les maladies cardiovasculaires.13 Avec une optimisation plus poussée des mesures, les wearables sans manchette pourraient à l'avenir être utilisés pour le dépistage de l'hypertension artérielle, le suivi du traitement et la titration des médicaments, et ce avec une plus grande facilité d'utilisation que les classiques tensiomètres avec manchette.23 Les différents types d'hypertension artérielle (p. ex. l'hypertension nocturne isolée ou liée à l'effort) pourront également être diagnostiqués avec plus de précision. Cependant, on ne dispose pas encore d'études à grande échelle pour ces indications.
Fibrillation auriculaire
Compte tenu du vieillissement de la population, la FA devient de plus en plus une entité endémique.1 Les wearables peuvent aider au diagnostic de la FA, tant asymptomatique que symptomatique.1 Ainsi, l'Apple Heart Study a évalué chez 419 297 patients si un dispositif basé sur la PPG pouvait diagnostiquer une FA chez des patients n'ayant pas d'antécédents de cette affection, et il est apparu que la valeur prédictive positive pour la détection de la FA en cas de pouls irrégulier était de 84 %. De plus, on a constaté que la combinaison du capteur PPG de l'Apple Watch et d'un algorithme de réseau neuronal profond permettait une très bonne prédiction de la FA comparativement à un ECG standard à 12 dérivations.24 L'étude HEARTLINE, actuellement en cours, est la première étude randomisée visant à déterminer si la détection de la FA à l'aide d'une Apple Watch permet ou non d'améliorer le pronostic des patients.
D'autres troubles du rythme pourront de plus en plus être diagnostiqués à l'aide de wearables, ce qui devrait réduire la nécessité de porter d'encombrants appareils Holter. Ainsi, une étude multicentrique portant sur 243 patients se présentant aux Urgences en raison de palpitations et de présyncope a montré un rendement diagnostique meilleur et plus rapide lors de l'utilisation d'un petit électrocardiographe portable par rapport aux soins de routine après 3 mois (détection d'un rythme cardiaque symptomatique chez 55,6 % vs 9,5 % des patients et après une moyenne de 9 jours vs 43 jours).25
Autres applications
Une intégration plus poussée des données obtenues à partir des wearables avec l'intelligence artificielle ouvre encore plus de possibilités. Ainsi, un algorithme semi-supervisé s'est avéré capable de prédire assez correctement un lipidogramme et une pression artérielle anormaux chez des patients, sur la base de données sur la fréquence cardiaque et les pas provenant de wearables (AUC 0,74 et 0,80 respectivement).26 Dans une autre étude, un algorithme a été capable de prédire une dysfonction ventriculaire avec une bonne précision, sur la base d'un ECG.27 On a également constaté que les patients présentant un résultat faussement positif avaient un risque 4 fois plus élevé de développer malgré tout une dysfonction ventriculaire au cours du suivi. Si de tels algorithmes peuvent être validés pour les ECG à 1 dérivation, ils pourraient être intégrés dans les wearables.
Traitement
L'utilisation potentielle des wearables dans le traitement des affections cardiaques peut être très large. Ci-dessous, nous décrivons 4 exemples dans lesquels leur utilisation pourrait offrir un avantage.
Syndrome coronarien aigu
Les ECG à 1 dérivation et les ECG basés sur la PPG sont classiquement utilisés pour la détection des troubles du rythme et ne conviennent pas pour le diagnostic d'un infarctus myocardique avec sus-décalage du segment ST (STEMI), car toute ischémie située en dehors de la zone de détection anatomique de la dérivation unique ne sera pas détectée. Cependant, si la précision d'un wearable devait augmenter au point de fournir un ECG à 12 dérivations correct, cela pourrait conduire à une réduction des coûts, du temps et de l'utilisation du personnel médical tout en augmentant le rendement diagnostique.28 Par conséquent, quelques études ont déjà été menées pour reproduire les dérivations précordiales, notamment avec une Apple Watch, en positionnant l'objet de manière séquentielle à différents endroits du thorax, ce qui s'avère précis s'il est appliqué correctement, mais pas très convivial pour le patient.28 De plus amples études sont donc nécessaires pour reproduire plus simplement un ECG complet.
Insuffisance cardiaque
Les patients hospitalisés en raison d'une insuffisance cardiaque décompensée seront ré-hospitalisés dans le mois dans 25 % des cas, ce qui est associé à une augmentation de la mortalité et des coûts des soins de santé.29,30 Il est donc important de prévenir une hospitalisation chez les patients souffrant d'insuffisance cardiaque, grâce à la détection précoce d'une décompensation débutante. L'étude MULTISENSE a permis de prédire à temps les événements liés à l'insuffisance cardiaque grâce à un algorithme basé sur les données des wearables.31 L'avantage de la télésurveillance par le biais de wearables sur les critères d'évaluation concrets chez ces patients a également déjà été examiné dans plusieurs études, mais avec des résultats différents. Ainsi, l'étude TIM-HF2 a montré que la mortalité toutes causes était plus faible chez les patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite symptomatique (NYHA II-III) qui étaient suivis à distance au moyen d'un ECG, d'un tensiomètre, d'un saturomètre et d'une balance, et ce par rapport aux patients recevant les soins standard.32 En revanche, des études similaires telles que TEN-HMS et TIM-HF n'ont pu montrer aucune différence.33,34 Cela peut s'expliquer par le fait que l'effet bénéfique de la télésurveillance peut également être attribué purement au suivi plus intensif de ce groupe de patients et pas nécessairement à l'utilisation de wearables en soi.35 En outre, il est difficile de comparer ces études entre elles, étant donné les différents critères d'inclusion et d'exclusion, ainsi que les différents types de capteurs. Des études à plus grande échelle avec un protocole standard sont donc nécessaires pour mieux définir l'utilité des wearables dans le suivi des patients souffrant d'insuffisance cardiaque.3 En outre, les wearables pourraient également contribuer à l'avenir à la détection d'une insuffisance cardiaque de novo dans la population générale. Ainsi, une étude pilote de moindre envergure réalisée en 2020 a montré que les données basées sur la PPG et les données accélérométriques d'un bracelet pouvaient prédire correctement l'insuffisance cardiaque décompensée chez 74 % des patients.36
FA connue
La mesure continue du rythme cardiaque peut offrir la possibilité de changer la définition catégorielle actuelle de la FA (p. ex. paroxystique, persistante, permanente) en une forme plus quantifiable, avec potentiellement de nouvelles indications pour l'anticoagulation et/ou le contrôle du rythme.3 Ainsi, on pourrait envisager de prendre un anticoagulant uniquement lors d'un épisode de FA. L'étude REACT.COM a montré une réduction de 94 % de l'utilisation d'anticoagulants si les patients porteurs d'un moniteur de rythme implanté ne prenaient d'anticoagulant que pendant un épisode de FA persistant > 1 heure.37 La sécurité d'une telle technique a déjà été confirmée par le passé38, bien que de plus amples études portant sur le risque d'AVC et la compliance thérapeutique restent nécessaires. En plus de l'application précédente, un wearable peut également aider à identifier une resinusalisation spontanée chez les patients chez qui une cardioversion élective est programmée, ce qui peut éviter des hospitalisations et des coûts inutiles.39 En outre, les wearables peuvent être utiles chez les patients présentant une FA permanente, pour optimiser davantage la réponse ventriculaire au repos et à l'effort.40
Revalidation cardiaque
La revalidation cardiaque est importante dans le traitement de diverses maladies cardiovasculaires, car elle combine des programmes d'exercices structurés, en vue d'une prévention secondaire du risque. La télérevalidation basée sur des données en temps réel provenant de wearables pourrait modifier l'organisation des programmes de revalidation. Ainsi, le taux de participation pourrait augmenter si une revalidation qualitative à domicile était possible. Dans ce contexte, une grande méta-analyse portant sur 2 890 patients a déjà montré que la revalidation cardiaque à domicile peut être aussi efficace que les programmes de revalidation centralisés.41 Une autre méta-analyse a montré que les wearables donnant des conseils d'exercice augmentaient la forme physique et le nombre de pas chez les patients cardiaques au cours de la phase d'entretien de leur trajet de revalidation cardiaque.42 Là encore, des études randomisées à grande échelle restent nécessaires pour définir plus précisément le rôle des wearables dans la revalidation cardiaque.
Conclusion
Petit à petit, les wearables font leur entrée dans la vie quotidienne, et la quantité de nouvelles informations qu'ils mettent à notre disposition est considérable. On peut s'attendre à ce qu'à l'avenir, ces appareils deviennent encore plus performants pour mesurer des processus plus complexes et qu'ils s'intègrent de plus en plus dans la pratique clinique quotidienne. Les possibilités d'optimiser la prise en charge des patients cardiaques sont énormes et il est donc capital que les cliniciens se familiarisent avec ces technologies.
Références
- Dagher, L., Shi, H., Zhao, Y. et al. Wearables in cardiology: Here to stay. Heart Rhythm, 2020, 17, 889-895.
- Kamišalic, A., Fister, I.J., Turkanovic, M. et al. Sensors and Functionalities of Non-Invasive Wrist-Wearable Devices: A Review. Sensors, 2018, 18 (6), 1714.
- Bayoumy, K., Gaber, M., Elshafeey, A. et al. Smart wearable devices in cardiovascular care: where we are and how to move forward. Nat Rev Cardiol, 2021, 18, 581-599.
- Blond, K., Brinkløv, C.F., Ried-Larsen, M. et al. Association of high amounts of physical activity with mortality risk: a systematic review and meta-analysis. Br J Sports Med, 2020, 54, 1195-1201.
- Yang, C-C., Hsu, Y-L. A review of accelerometry-based wearable motion detectors for physical activity monitoring. Sensors, 2010, 10, 7772-7788.
- Troiano, R.P., McClain, J.J., Brychta, R.J. et al. Evolution of accelerometer methods for physical activity research. Br J Sports Med, 2014, 48, 1019-1023.
- Zhang, D., Wang, W., Li, F. Association between resting heart rate and coronary artery disease, stroke, sudden death and noncardiovascular diseases: a meta-analysis. CMAJ, 2016, 188, E384-E392.
- Fox, K., Ford, I., Steg, P.G. et al. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomised controlled trial. The Lancet, 2008, 372, 817-821.
- Singh, N., Moneghetti, K.J., Christle, J.W. et al. Heart Rate Variability: An Old Metric with New Meaning in the Era of Using mHealth technologies for Health and Exercise Training Guidance. Part Two: Prognosis and Training. Arrhythmia Electrophysiol Rev, 2018, 7, 247-255.
- Cobos Gil, M.Á. Standard and Precordial Leads Obtained With an Apple Watch. Ann Intern Med, 2020, 172, 436-437.
- Allen, J. Photoplethysmography and its application in clinical physiological measurement. Physiol Meas, 2007, 28, R1-39.
- Etiwy, M., Akhrass, Z., Gillinov, L. et al. Accuracy of wearable heart rate monitors in cardiac reha bili tation. Cardiovasc Diagn Ther, 2019, 9, 262-271.
- Whelton, P.K., Carey, R.M., Aronow, W.S. et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/ APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical P. Hypertension, 2018, 71, e13-e115.
- Muniyandi, M., Sellappan, S., Chellaswamy, V. et al. Diagnostic accuracy of mercurial versus digital blood pressure measurement devices: a systematic review and meta-analysis. Sci Rep, 2022, 12, 3363.
- Elgendi, M., Fletcher, R., Liang, Y. et al. The use of photoplethysmography for assessing hypertension. NPJ Digit Med, 2019, 2, 60.
- Kim, J., Campbell, A.S., de Ávila, BE-F. et al. Wearable biosensors for healthcare monitoring. Nat Biotechnol, 2019, 37, 389-406.
- Sana, F., Isselbacher, E.M., Singh, J.P. et al. Wearable Devices for Ambulatory Cardiac Monitoring: JACC State-of-the-Art Review. J Am Coll Cardiol, 2020, 75, 1582-1592.
- LaMonte, M.J., Buchner, D.M., Rillamas-Sun, E. et al. Accelerometer-Measured Physical Activity and Mortality in Women Aged 63 to 99. J Am Geriatr Soc, 2018, 66, 886-894.
- Borgundvaag, E., Janssen, I. Objectively Measured Physical Activity and Mortality Risk Among American Adults. Am J Prev Med, 2017, 52, e25-e31.
- Dohrn, I-M., Sjöström, M., Kwak, L. et al. Accelerometer-measured sedentary time and physical activity-A 15 year follow-up of mortality in a Swedish population-based cohort. J Sci Med Sport, 2018, 21, 702-707.
- Martin, S.S., Feldman, D.I., Blumenthal, R.S. et al. mActive: A Randomized Clinical Trial of an Automated mHealth Intervention for Physical Activity Promotion. J Am Heart Assoc, 2015, 4 (11), e002239.
- Patel, M.S., Benjamin, E.J., Volpp, K.G. et al. Effect of a Game-Based Intervention Designed to Enhance Social Incentives to Increase Physical Activity Among Families: The BE FIT Randomized Clinical Trial. JAMA Intern Med, 2017, 177, 1586-1593.
- Kuwabara, M., Harada, K., Hishiki, Y. et al. Validation of two watch-type wearable blood pressure monitors according to the ANSI/ AAMI/ISO81060-2:2013 guidelines: Omron HEM-6410T-ZM and HEM-6410T-ZL. J Clin Hypertens, 2019, 21, 853-858.
- Tison, G.H., Sanchez, J.M., Ballinger, B. et al. Passive Detection of Atrial Fibrillation Using a Commercially Available Smartwatch. JAMA Cardiol, 2018, 3, 409-416.
- Reed, M.J., Grubb, N.R., Lang, C.C. et al. Multi-centre Randomised Controlled Trial of a Smartphone-based Event Recorder Alongside Standard Care Versus Standard Care for Patients Presenting to the Emergency Department with Palpitations and Pre-syncope: The IPED (Investigation of Palpitations in the ED) study. EClinicalMedicine, 2019, 8, 37-46.
- Ballinger, B., Hsieh, J., Singh, A. et al. DeepHeart: Semi-Supervised Sequence Learning for Cardiovascular Risk Prediction. Proc AAAI Conf Artif Intell, 2018, 32 (1).
- Attia, Z.I., Kapa, S., Lopez-Jimenez, F. et al. Screening for cardiac contractile dysfunction using an artificial intelligence-enabled electrocardiogram. Nat Med, 2019, 25, 70-74.
- Sprenger, N., Sepehri Shamloo, A., Schäfer, J. et al. Feasibility and Reliability of Smartwatch to Obtain Precordial Lead Electrocardiogram Recordings. Sensors, 2022, 22 (3), 1217.
- Ryan, A.M., Nallamothu, B.K., Dimick, J.B. Medicare's public reporting initiative on hospital quality had modest or no impact on mortality from three key conditions. Health Aff, 2012, 31, 585-592.
- Dunlay, S.M., Shah, N.D., Shi, Q. et al. Lifetime costs of medical care after heart failure diagnosis. Circ Cardiovasc Qual Outcomes, 2011, 4, 68-75.
- Boehmer, J.P., Hariharan, R., Devecchi, F.G. et al. A Multisensor Algorithm Predicts Heart Failure Events in Patients With Implanted Devices: Results From the MultiSENSE Study. JACC Heart Fail, 2017, 5, 216-225.
- Koehler, F., Koehler, K., Deckwart, O. et al. Efficacy of telemedical interventional management in patients with heart failure (TIM-HF2): a randomised, controlled, parallel- group, unmasked trial. The Lancet, 2018, 392, 1047-1057.
- Cleland, J.G.F., Louis, A.A., Rigby, A.S. et al. Noninvasive home telemonitoring for patients with heart failure at high risk of recurrent admission and death: the Trans- European Network-Home-Care Management System (TEN-HMS) study. J Am Coll Cardiol, 2005, 45, 1654-1664.
- Koehler, F., Winkler, S., Schieber, M. et al. Impact of remote telemedical management on mortality and hospitalizations in ambulatory patients with chronic heart failure: the telemedical interventional monitoring in heart failure study. Circulation, 2011, 123, 1873-1880.
- Dendale, P., De Keulenaer, G., Troisfontaines, P. et al. Effect of a telemonitoring-facilitated collaboration between general practitioner and heart failure clinic on mortality and rehospitalization rates in severe heart failure: the TEMA-HF 1 (TElemonitoring in the MAnagement of Heart Failure) study. Eur J Heart Fail, 2012, 14, 333-340.
- Shah, A.J., Isakadze, N., Levantsevych, O. et al. Detecting heart failure using wearables: a pilot study. Physiol Meas, 2020, 41, 44001.
- Passman, R., Leong-Sit, P., Andrei, A-C. et al. Targeted Anticoagulation for Atrial Fibrillation Guided by Continuous Rhythm Assessment With an Insertable Cardiac Monitor: The Rhythm Evaluation for Anticoagulation With Continuous Monitoring (REACT.COM) Pilot Study. J Cardiovasc Electrophysiol, 2016, 27, 264-270.
- Zado, E.S., Pammer, M., Parham, T. et al. 'As Needed' nonvitamin K antagonist oral anticoagulants for infrequent atrial fibrillation episodes following atrial fibrillation ablation guided by diligent pulse monitoring: A feasibility study. J Cardiovasc Electrophysiol, 2019, 30, 631-638.
- Bumgarner, J.M., Lambert, C.T., Hussein, A.A. et al. Smartwatch Algorithm for Automated Detection of Atrial Fibrillation. J Am Coll Cardiol, 2018, 71, 2381-2388.
- Elshazly, M.B., Wilkoff, B.L., Tarakji, K. et al. Exercise Ventricular Rates, Cardiopulmonary Exercise Performance, and Mortality in Patients With Heart Failure With Atrial Fibrillation. Circ Heart Fail, 2021, 14, e007451.
- Anderson, L., Sharp, G.A., Norton, R.J. et al. Home-based versus centre-based cardiac rehabilitation. Cochrane database Syst Rev, 2017, 6, CD007130.
- Hannan, A.L., Harders, M.P., Hing, W. et al. Impact of wearable physical activity monitoring devices with exercise prescription or advice in the maintenance phase of cardiac rehabilitation: systematic review and meta-analysis. BMC Sport Sci Med Rehabil, 2019, 11, 14.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.