Met bijna 22 200 slachtoffers per jaar in België zijn cerebrovasculaire accidenten (CVA) nog steeds een van de voornaamste oorzaken van overlijden aan cardiovasculaire aandoeningen. Ze vertegenwoordigen dan ook de derde belangrijkste doodsoorzaak. Vooral oudere mensen worden getroffen, maar ook jongeren blijven niet buiten schot en de gevolgen kunnen ernstig zijn. Ongeveer een derde van de ischemische CVA's blijft cryptogeen na een eerste evaluatie.1 Volgens de database van het National Institute of Neurological and Communicative Disorders and Stroke is twee derde van de cryptogene beroertes afkomstig van cardiale of aortabronnen.2 In meer dan 90 % van de gevallen is de bron van de cardiale trombo-embolie de linkeratriumappendix (LAA) of het linkerhartoor, met LA-myopathie en atriumfibrilleren (AF) als belangrijkste bijdragers.3-5 Obliteratie van de LAA - zowel chirurgisch als percutaan - is bewezen niet inferieur aan warfarine om een ischemische beroerte te voorkomen.6, 7 Aangezien het jaarlijkse recidiefpercentage van een beroerte tot 5 % oploopt, is het van groot klinisch belang om het onderliggende mechanisme te onderzoeken om zo therapie op maat toe te laten.8
AF is de meest voorkomende hartritmestoornis.9 Subklinisch AF als oorzaak van een beroerte kan bij een standaard 24-uurshartbewaking onopgemerkt blijven. Daarom moet een implanteerbare hartmonitor (ICM) worden overwogen om occult AF te ontmaskeren. In het CRYSTAL-AF-onderzoek toonde een op ICM-gebaseerde strategie een AF-incidentie van 30 % na drie jaar, vergeleken met 10 % in een gematchte cohorte met routinematige follow-up (voornamelijk 24-uursholtermonitoring).10 ICM blijft echter onderbenut in deze patiënten populatie omdat het een invasieve strategie betreft die de patiënt angst kan inboezemen en gepaard gaat met een aanzienlijke kost. Empirisch gebruik van anticoagulatietherapie bij alle cryptogeneberoertepatiënten is bewezen schadelijk11, terwijl die therapie bij patiënten met een beroerte en AF het risico op een herhaling van een beroerte vermindert in vergelijking met aspirine.12 Daarom is het belangrijk patiënten met een verhoogd risico op AF vroegtijdig te identificeren en hen op te nemen in een traject waar ritmemonitoring centraal staat. Echocardiografie kan als een tool dienen om dit te verwezenlijken.
Echografie van het linkerhartoor
De LAA is een actief contraherend restant van het embryogene LA en kent grote interindividuele verschillen op vlak van grootte, vorm en oriëntatie.13 Kennis van de anatomie wordt steeds belangrijker, mede in het licht van transcutane procedures/sluitingen. Transoesofageale echocardiografie maakt gedetailleerde beeldvorming mogelijk met grote spatiële resolutie en 180-gradenvisualisatie (multiplane). De sensitiviteit en specificiteit om LAA-tromboses uit te sluiten zijn respectievelijk 92 en 98 %.13 De spiertrabekels of de akoestische schaduw van het ligament van Marshall worden soms foutief ingeschat als trombus. Ondanks de posterieure ligging en de hogere complexiteit, kan het linkerhartoor ook vaak worden gezien bij transthoracale echocardiografie, vanuit het apicale twee kamerbeeld, eventueel gebruikmakend van intraveneus echocontrast. Om de anatomie en functie van het hartoor in beeld te brengen wordt steeds vaker gebruik gemaakt van cardiale computertomografie (CT) en magnetische resonantie (MRI), voornamelijk voor onderzoeksdoeleinden.
LAA-vorm en -grootte
Doorgaans kent de LAA een duidelijke opening vanuit het LA die leidt naar een halsgebied dat uitkomt op het lichaam. Uit een post-mortemonderzoek is gebleken dat er vanuit het lichaam meestal twee lobben ontstaan, maar tot vierlobbige hartoortjes zijn beschreven.14 In een meer recente studie worden er op basis van CT en MRI vier morfologische types (figuur 1) omschreven waarbij de 'kippenvleugel' het meest voorkomt (48 %), gevolgd door 'cactus' (30 %), 'windzak' (19 %) en 'bloemkool' (3 %).15 In tegenstelling tot wat de naam doet vermoeden, beschermt de kippenvleugel het meest tegen emboligene CVA's en kent de bloemkoolformatie het grootste risico op trombose.13, 15 Ook de diameter van de hals, de diepte en het totale volume van het linkerhartoor zijn gelinkt aan het risico op beroerte.4 Hoe complexer de anatomie van het linkerhartoortje, hoe groter het trombogene risico.

LAA-functie
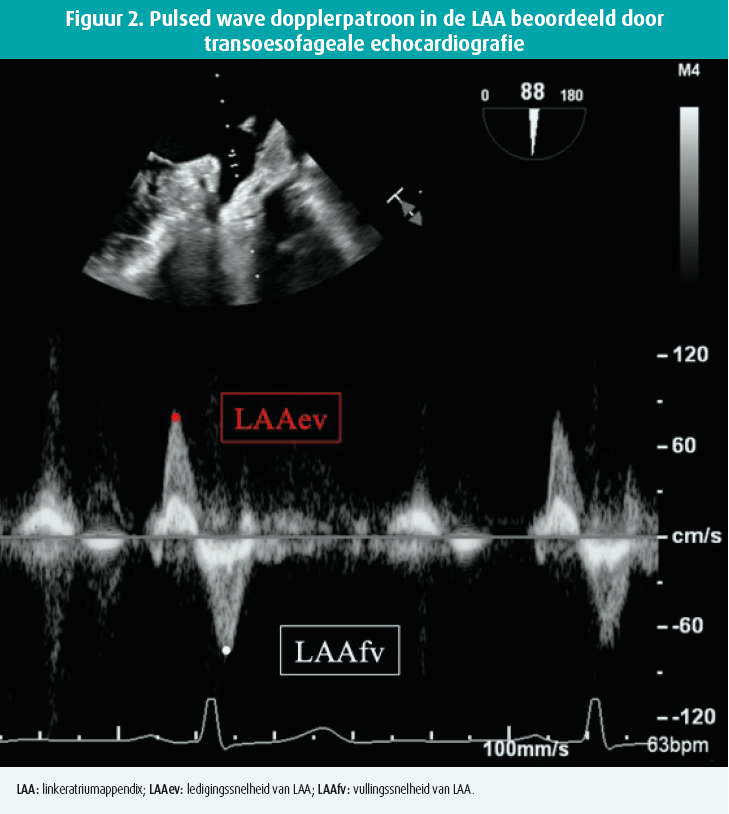
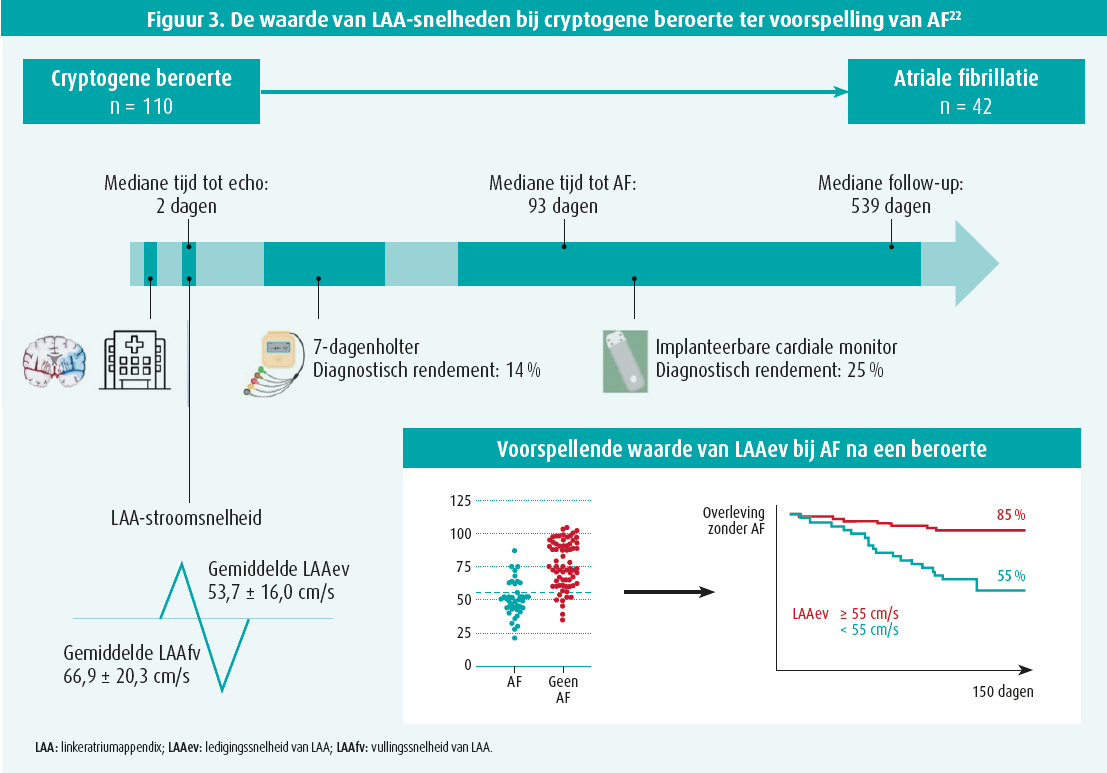
Pulsed wave doppleronderzoek om de LAA-functie te kwantificeren, is naar voren gekomen als een instrument om trombusvorming bij AF-patiënten te voorspellen. Figuur 2 toont dat een dopplersample het best wordt gealigneerd via kleurendoppler en dat het geplaatst moet worden in het eerste proximale derde van het linkerhartoortje (waar de snelheid het hoogst is).17, 18 In sinusritme is het signaal bifasisch, bij AF is het chaotisch en herkennen we doorgaans een zaagtandpatroon. De eerste positieve deflexie komt voor aan het einde van de diastole (kort na de P-top) en weerspiegelt actieve contractie (ledigingssnelheid). De tweede is een retrograde golf die vulling weerspiegelt (vullingssnelheid).18 In de SPAF III-studie kwam trombusvorming vaker voor bij AF-patiënten wanneer de ledigings snelheid lager was dan 20 cm/s (relatief risico op een beroerte 2,6).19 Bovendien kan de LAA-ledigingssnelheid tijdens AF het succes op resinusalisatie na cardioversie en pulmonale venen isolatie voorspellen.20, 21 Uit eigen onderzoek (figuur 3) blijkt nu ook dat de ledigingssnelheid bij patiënten in sinusritme goed correleert met het risico op de latere ontwikkeling van AF.22 Een cut-offwaarde van 55 cm/s is geassocieerd met een uitstekend discriminerend vermogen (sensitiviteit van 90 % en specificiteit van 76 %) om cryptogene-beroertepatiënten met een hoog risico op AF te identificeren. In vergelijking met andere klinische en echocardiografische parameters was de ledigingssnelheid onafhankelijk en het sterkst geassocieerd met de incidentie van AF in de toekomst.22
Atriale myopathie als substraat voor AF en trombus
Conversie van AF naar sinusritme resulteert in een voorbijgaande mechanische disfunctie van het LA, aangeduid als stunning, en onderstreept het belang van anticoagulantia in de eerste weken na elektrische of farmacologische cardioversie.23 Verminderde functie van het LA(A), geobjectiveerd door bv. strain of doppler, vroeg na een beroerte kan daarom wijzen op een recente episode van AF als etiologie.24 Toch is het tijdelijke verband tussen AF en beroerte verre van consistent. In grote cohorten pacemakerpatiënten werd vastgesteld dat slechts 8 % subklinisch AF had in de 30 dagen voor hun ischemische beroerte en dat AF pas werd vastgelegd na de ischemische beroerte bij 30 % van de patiënten.25-27 Meer en meer wordt gesuggereerd dat AF slechts een uiting is van een onderliggende LA-ziekte en dat deze laatste op zichzelf al (onafhankelijk van AF) een trombogeen milieu creëert. Deze hypothese kwam mede naar voren uit een subanalyse van de WARSS-trial waarin werd gevonden dat antistolling superieur was aan aspirine voor secundaire (cryptogene)-beroertepreventie bij patiënten met een verhoogd serum natriuretische peptiden als biomarker voor atriale disfunctie.28 Bovendien is de mate van LA-fibrose (> 20 %) op cardiale MRI in verband gebracht met LAA-trombus bij patiënten onafhankelijk van AF.29 De ARCADIA-studie waarin apixaban versus aspirine wordt getest ter preventie van een recidief bij patiënten met een cryptogene beroerte en atriale cardiomyopathie, is momenteel in rekrutering. De klinische implementatie is evenwel veraf, aangezien er nog geen consensus bestaat over het definiëren van atriale myopathie.
Conclusie
Ondanks de sterke associatie tussen de anatomie en functie van het LAA en het trombogene risico, wordt de indicatiestelling voor anticoagulerende therapie momenteel zo goed als exclusief gesteld op basis van het elektrocardiogram en de CHA2DS2-VASc-score. Het vaak asymptomatische en paroxysmale voorkomen maakt de diagnose van AF soms ongrijpbaar. Echocardiografische functiebepaling van het LAA na een cryptogene beroerte kan de clinicus helpen om patiënten te identificeren bij wie men extra beducht moet zijn op AF en snel moet overgaan naar een implanteerbare hartmonitor. Nieuwe inzichten suggereren dat AF en LAA-trombi beide een uiting zijn van een onderliggende ziekte van het LA(A). Of deze laatste op zich een indicatie zou kunnen zijn voor anticoagulerende therapie (onafhankelijk van AF) wordt momenteel in prospectief onderzoek getoetst.
Referenties
- Kamel, H., Healey, J.S. Cardioembolic Stroke. Circ Res, 2017, 120 (3), 514-526.
- Sacco, R.L., Ellenberg, J.H., Mohr, J.P., Tatemichi, T.K., Hier, D.B., Price, T.R. et al. Infarcts of undetermined cause: the NINCDS Stroke Data Bank. Ann Neurol, 1989, 25 (4), 382-390.
- Odell, J.A., Blackshear, J.L., Davies, E., Byrne, W.J., Kollmorgen, C.F., Edwards, W.D. et al. Thoracoscopic obliteration of the left atrial appendage: potential for stroke reduction? Ann Thorac Surg, 1996, 61 (2), 565-569.
- Fang, R., Li, Y., Wang, J., Wang, Z., Allen, J., Ching, C.K. et al. Stroke risk evaluation for patients with atrial fibrillation: Insights from left atrial appendage. Front Cardiovasc Med, 2022, 9.
- Handke, M., Harloff, A., Hetzel, A., Olschewski, M., Bode, C., Geibel, A. Left Atrial Appendage Flow Velocity as a Quantitative Surrogate Parameter for Thromboembolic Risk: Determinants and Relationship to Spontaneous Echocontrast and Thrombus Formation-A Transesophageal Echocardiographic Study in 500 Patients with Cerebral Ischemia. J Am Soc Echocardiogr, 2005, 18 (12), 1366-1372.
- Whitlock, R.P., Belley-Cote, E.P., Paparella, D., Healey, J.S., Brady, K., Sharma, M. et al. Left Atrial Appendage Occlusion during Cardiac Surgery to Prevent Stroke. N Eng J Med, 2021, 384 (22), 2081-2091.
- Reddy, V.Y., Sievert, H., Halperin, J., Doshi, S.K., Buchbinder, M., Neuzil, P. et al. Percutaneous Left Atrial Appendage Closure vs Warfarin for Atrial Fibrillation: A Randomized Clinical Trial. JAMA, 2014, 312 (19), 1988-1998.
- Yaghi, S., Bernstein, R.A., Passman, R., Okin, P.M., Furie, K.L. Cryptogenic Stroke. Circ Res, 2017, 120 (3), 527-540.
- Lippi, G., Sanchis-Gomar, F., Cervellin, G. Global epidemiology of atrial fibrillation: An increasing epidemic and public health challenge. Int J Stroke, 2021, 16 (2), 217-221.
- Sanna, T., Diener, H-C., Passman, R.S., Lazzaro, V.Di., Bernstein, R.A., Morillo, C.A. et al. Cryptogenic Stroke and Underlying Atrial Fibrillation. N Eng J Med, 2014, 370, 2478-2486.
- Hart, R.G., Sharma, M., Mundl, H., Kasner, S.E., Bangdiwala, S.I., Berkowitz, S.D. Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Eng J Med, 2018, 378, 2191-2201.
- Lip, G.Y.H., Lane, D.A. Stroke prevention in atrial fibrillation: a systematic review. JAMA, 2015, 313, 1950-1962.
- Beigel, R., Wunderlich, N.C., Ho, S.Y., Arsanjani, R., Siegel, R.J. The left atrial appendage: anatomy, function, and noninvasive evaluation. JACC Cardiovasc Imaging, 2014, 7, 1251-1265.
- Veinot, J.P., Harrity, P.J., Gentile, F., Khandheria, B.K., Bailey, K.R., Eickholt, J.T. et al. Anatomy of the normal left atrial appendage: a quantitative study of age-related changes in 500 autopsy hearts: implications for echocardiographic examination. Circulation, 1997, 96, 3112-3115.
- Di Biase, L., Santangeli, P., Anselmino, M., Mohanty, P., Salvetti, I., Gili, S. et al. Does the left atrial appendage morphology correlate with the risk of stroke in patients with atrial fibrillation? Results from a multicenter study. J Am Coll Cardiol, 2012, 60, 531-538.
- Korhonen, M., Muuronen, A., Arponen, O., Mustonen, P., Hedman, M., Jäkälä, P. et al. Left atrial appendage morphology in patients with suspected cardiogenic stroke without known atrial fibrillation. PLoS One, 2015, 10 (3), e0118822.
- Chan, S.K., Kannam, J.P., Douglas, P.S., Manning, W.J. Multiplane transesophageal echocardiographic assessment of left atrial appendage anatomy and function. Am J Cardiol, 1995, 76, 528-530.
- Agmon, Y., Khandheria, B.K., Gentile, F., Seward, J.B. Echocardiographic assessment of the left atrial appendage. J Am Coll Cardiol, 1999, 34, 1867-1877.
- Goldman, M.E., Pearce, L.A., Hart, R.G., Zabalgoitia, M., Asinger, R.W., Safford R. et al. Pathophysiologic correlates of thromboembolism in nonvalvular atrial fibrillation: I. Reduced flow velocity in the left atrial appendage (The Stroke Prevention in Atrial Fibrillation [SPAF-III] study). J Am Soc Echocardiogr, 1999, 12, 1080-1087.
- Antonielli, E., Pizzuti, A., Pálinkás, A., Tanga, M., Gruber, N., Michelassi, C. et al. Clinical value of left atrial appendage flow for prediction of long-term sinus rhythm maintenance in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol, 2002, 39, 1443-1449.
- Tabata, T., Oki, T., Iuchi, A., Yamada, H., Manabe, K., Fukuda, K. et al. Evaluation of Left Atrial Appendage Function by Measurement of Changes in Flow Velocity Patterns After Electrical Cardioversion in Patients With Isolated Atrial Fibrillation. Am J Cardiol, 1997, 79, 615-620.
- Dhont, S., Wouters, F., Deferm, S., Bekelaar, K., Gruwez, H., Meekers, E. et al. Reduced Left Atrial Appendage Flow Is Associated With Future Atrial Fibrillation After Cryptogenic Stroke. J Am Soc Echocardiogr, 2023.
- Louie, E.K., Liu, D., Reynertson, S.I., Loeb, H.S., McKiernan, T.L., Scanlon, P.J. et al. 'Stunning' of the left atrium after spontaneous conversion of atrial fibrillation to sinus rhythm: Demonstration by transesophageal Doppler techniques in a canine model. J Am Coll Cardiol, 1998, 32, 2081-2086.
- Deferm, S., Bertrand, P.B., Churchill, T.W., Sharma, R., Vandervoort, P.M., Schwamm, L.H. et al. Left Atrial Mechanics Assessed Early during Hospitalization for Cryptogenic Stroke Are Associated with Occult Atrial Fibrillation: A Speckle-Tracking Strain Echocardiography Study. J Am Soc Echocardiogr, 2021, 34, 156-165.
- Kamel, H., Okin, P.M., Elkind, M.S.V., Iadecola, C. Atrial Fibrillation and Mechanisms of Stroke: Time for a New Model. Stroke, 2016, 47, 895-900.
- Singer, D.E., Ziegler, P.D., Koehler, J.L., Sarkar, S., Passman, R.S. Temporal Association Between Episodes of Atrial Fibrillation and Risk of Ischemic Stroke. JAMA Cardiol, 2021, 6, 1364-1369.
- Glotzer, T.V., Daoud, E.G., Wyse, D.G., Singer, D.E., Ezekowitz, M.D., Hilker, C. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circ Arrhythm Electrophysiol, 2009, 2, 474-480.
- Longstreth, W.T., Kronmal, R.A., Thompson, J.L.P., Christenson, R.H., Levine, S.R., Gross, R. et al. Amino terminal pro-B-type natriuretic peptide, secondary stroke prevention, and choice of antithrombotic therapy. Stroke, 2013, 44, 714.
- Akoum, N., Fernandez, G., Wilson, B., Mcgann, C., Kholmovski, E., Marrouche, N. Association of atrial fibrosis quantified using LGE-MRI with atrial appendage thrombus and spontaneous contrast on transesophageal echocardiography in patients with atrial fibrillation. J Cardiovasc Electrophysiol, 2013, 24, 1104-1109.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.