In de klinische praktijk lijden patiënten die zich presenteren met een ST-elevatie myocardinfarct (STEMI) frequent aan meertakslijden en de bestaande evidentie ondersteunt het belang van complete revascularisatie bij deze patiënten.1,2 De optimale timing van de revascularisatie van niet-oorzakelijke coronaire letsels blijft echter een discussiepunt, waarbij het onduidelijk is of er een percutane coronaire interventie (PCI) van deze letsels moet gebeuren tijdens de indexprocedure, of binnen de 45 dagen na primaire PCI.3,4 De MULTISTARS AMI (MULTivessel Immediate versus STAged RevaScularization in Acute Myocardial Infarction)-trial werd ontworpen om een antwoord te bieden op deze pertinente vraag uit de klinische praktijk.5 De resultaten van deze trial werden in augustus 2023 gepubliceerd in The New England Journal of Medicine en werden gelijktijdig gepresenteerd door Barbara E. Stähli (Zürich, Zwitserland) tijdens een van de hotlinesessies op het ESC-congres.6
Methodologie
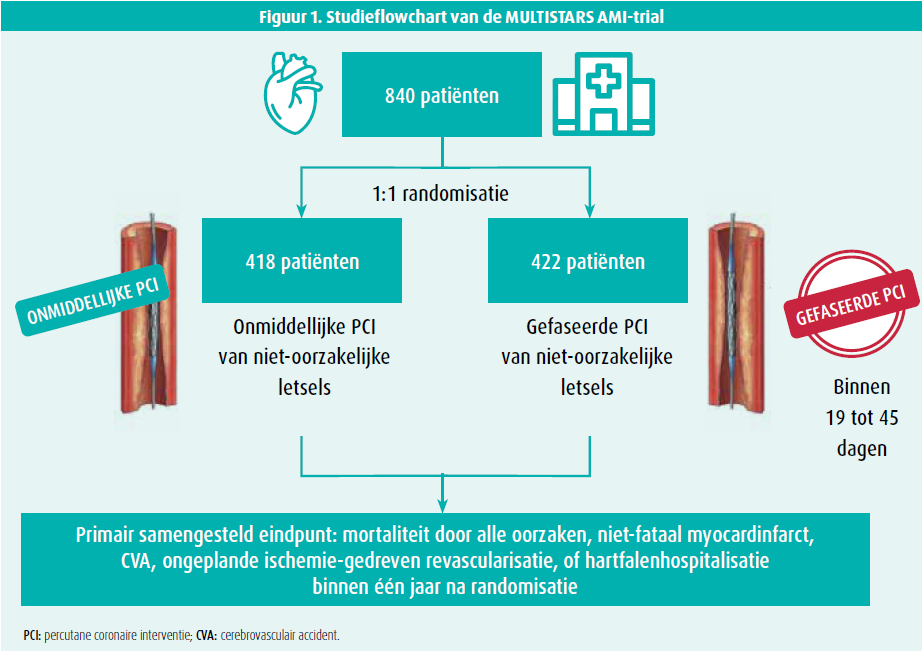
De MULTISTARS AMI-trial werd gecoördineerd door het Andreas Grüntzig Clinical Research Center van het Universitair Ziekenhuis van Zürich in Zwitserland. Het was een internationale, gerandomiseerde, open-label trial waarbij tussen oktober 2016 en juni 2022 patiënten van 37 Europese centra werden geïncludeerd. Het primaire doel van deze studie was om na te gaan of onmiddellijke revascularisatie van niet-oorzakelijke coronaire letsels bij hemodynamisch stabiele patiënten met een acuut STEMI en meertakslijden na succesvolle primaire PCI van het oorzakelijke coronaire letsel non-inferieur is aan gefaseerde revascularisatie van deze niet-oorzakelijke letsels (binnen de 19 tot 45 dagen na primaire PCI). Meertakslijden werd gedefinieerd als ten minste één niet-oorzakelijk coronair letsel met minstens 70 % stenose op coronarografie. Er werden in totaal 840 patiënten 1:1 gerandomiseerd (figuur 1), waarbij er 418 patiënten in de onmiddellijke PCI-groep en 422 patiënten in de gefaseerde PCI-groep werden ingedeeld onder de vorm van een 'intention-to-treat'-analyse. Er werd geadviseerd aan de interventionele cardiologen om een everolimus-eluting stent te gebruiken, gecombineerd met de standaard zorg conform de huidige richtlijnen. Het primaire eindpunt was een samenstelling van mortaliteit door alle oorzaken, niet-fataal myocardinfarct, cerebrovasculair accident (CVA), ongeplande ischemie-gedreven revascularisatie, of hartfalenhospitalisatie binnen één jaar na randomisatie. De volgende exclusiecriteria werden gehanteerd: cardiogene shock, nood aan urgente bypassoperatie (CABG), voorgeschiedenis van CABG, stenttrombose, in-stent restenose, chronische totale occlusie (CTO) van een majeure coronair, hoofdstamletsel of letsel van de ostiale LAD of RCx en enige contra-indicatie voor duale antiplaatjestherapie voor ten minste 90 dagen (buiten patiënten onder orale anticoagulantia). Het voorkomen van het primaire eindpunt werd in beide studiearmen geschat op 18 %, waarbij een sample size van 800 patiënten werd berekend. Rekening houdend met een 5 % drop-out ratio werden 840 patiënten gerekruteerd. De totale opvolgingstijd van de patiënten bedroeg één jaar.
Resultaten
Drop-out bleef relatief beperkt in beide groepen met een succesvolle opvolging van 97,8 % in de onmiddellijke PCI-groep en 97,4 % in de gefaseerde PCI-groep. Cross-over tussen groepen was eveneens relatief laag met 2,9 % cross-over van de onmiddellijke PCI-groep naar de gefaseerde PCI-groep. De gemiddelde leeftijd van de geïncludeerde patiënten was 65 jaar, 80 % was mannelijk, 98 % was Kaukasisch en 15 % leed aan diabetes mellitus. Van alle geïncludeerde patiënten leed 80 % aan tweetakslijden en 20 % aan drietakslijden, een radiale toegang tijdens de procedure werd bekomen bij > 70 % van de patiënten, de gemiddelde hospitalisatieduur was 4 (3-6) dagen in de onmiddellijke PCI-groep en 5 (4-7) dagen in de gefaseerde PCI-groep. Metingen van fractionele flowreserve en intraprocedurele beeldvormingstechnieken werden relatief weinig gebruikt in beide groepen. De totale hoeveelheid gebruikt contrast lag lager in de onmiddellijke PCIgroep (gemiddeld 250 ml vs. 333 ml), en er was binnen deze groep een significant lagere totale fluoroscopietijd (gemiddeld 18 min. vs. 24 min.) en een kortere totale proceduretijd (gemiddeld 73 min. vs. 105 min.).
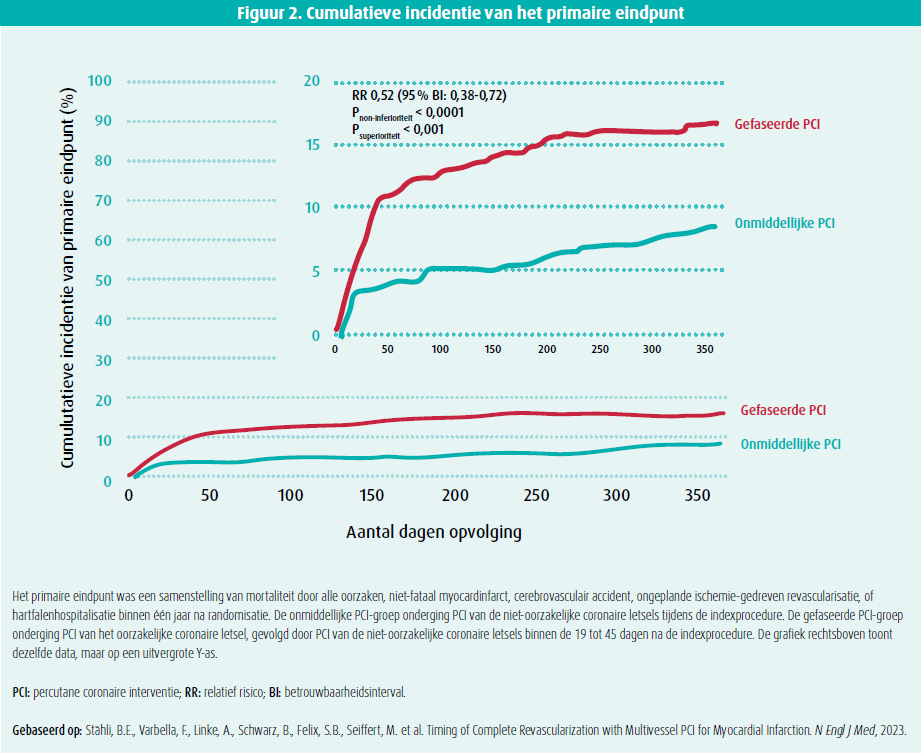
Het primaire eindpunt lag significant lager in de onmiddellijke PCI-groep (8,5 %) vergeleken met de gefaseerde PCI-groep (16,3 %) (figuur 2). Hierbij was er dus een relatief risico van 0,52 (95 % betrouwbaarheidsinterval [BI]: 0,38-0,72), met een P-waarde < 0,0001 voor non-inferioriteit en < 0,001 voor superioriteit. Op vlak van secundaire uitkomsten was er een significant lager risico in de onmiddellijke PCI-groep op niet-fataal myocardinfarct (2,0 % vs. 5,3 %) en ongeplande ischemie-gedreven revascularisatie (4,1 % vs. 9,3 %). Er was geen significant verschil tussen beide groepen op vlak van stenttrombose (1,2 % vs. 1,4 %), acute nierinsufficiëntie (3,6 % vs. 2,9 %) en majeure bloedingen (3,1 % vs. 4,8 %). Subgroepanalyses toonden geen heterogeniteit op vlak van leeftijd, geslacht, diabetes mellitus, symptoom-tot-ballontijd, toegangsite van indexprocedure, infarctlocatie, aantal coronairen met niet-oorzakelijke letsels en type P2Y12-inhibitor.
Conclusie
De auteurs stellen als conclusie dat, gebaseerd op het primaire eindpunt, onmiddellijke PCI van niet-oorzakelijke coronaire letsels in hemodynamisch stabiele patiënten met STEMI en meertakslijden non-inferieur is ten opzichte van gefaseerde PCI. Daarnaast heeft onmiddellijke PCI ook voordelen, zoals een reductie in de noodzakelijke hoeveelheid contrast/materiaal, en is het dus ook kosteneffectiever ten opzichte van gefaseerde PCI.
Kritische bespreking
De MULTISTARS AMI-trial werd positief onthaald tijdens de nabespreking op het ESC-congres. Robert A. Byrne (Dublin, Ierland) benadrukte hier nogmaals dat complete revascularisatie essentieel is bij acuut coronaire syndromen (ACS), aangezien meertakslijden voorkomt in tot 50 % van de patiënten die zich presenteren met een STEMI. Bij deze patiënten is in 30 tot 50 % van de gevallen een PCI van significante niet-oorzakelijke letsels noodzakelijk, ofwel onmiddellijk na primaire PCI, ofwel binnen de 45 dagen na de indexprocedure.1,2 Er is echter een grote variabiliteit in timing, waarbij ongeveer één derde van deze PCI's onmiddellijk plaatsvindt, één derde vindt plaats tijdens dezelfde hospitalisatie en één derde gebeurt ambulant binnen de 45 dagen na ontslag.7 De nieuwe ECS-richtlijnen over ACS geven een striktere aanbeveling met een level IA-evidentie voor complete revascularisatie in geval van STEMI met meertakslijden (onmiddellijk of binnen de 45 dagen).8 De evidentie voor deze nieuwe aanbeveling wordt ondersteund door de recente toename in gerandomiseerde klinische trials betreffende PCI van enkel het oorzakelijke letsel vs. complete revascularisatie.2,9-12 De timing van complete revascularisatie is echter zeer variabel in deze studies, in de MULTISTARS AMI-trial was het gemiddelde interval in de gefaseerde PCI-groep 37 (30-43) dagen. De kaplan-meiercurves van beide groepen gaan reeds vroegtijdig uit elkaar, met een hoge graad van significantie voor non-inferioriteit6 (figuur 2, rechter bovenpaneel). De BIOVASC-trial, die recent gepubliceerd werd in The Lancet, ondersteunt de resultaten van de MULTISTARS AMI-trial. Deze studie toonde eveneens een non-inferioriteit aan voor onmiddellijke PCI ten opzichte van gefaseerde PCI bij patiënten met een ACS en meertakslijden, 40 % van de patiënten in deze studie presenteerde met een STEMI.13 Ondanks dat de MULTISTARS AMI-trial niet ontworpen werd om superioriteit aan te tonen, is er ook hier een hoge graad van significantie.6 Er was hierbij geen significant verschil in mortaliteit tussen de onmiddellijke PCI-groep en de gefaseerde PCI-groep (2,9 % vs. 2,6 %). Er was eveneens geen verschil in CVA (1,2 % vs. 1,7 %) en hartfalenhospitalisatie (1,2 % vs. 1,4 %). Wel waren er minder niet-fatale myocardinfarcten in de onmiddellijke PCI-groep (2,0 % vs. 5,3 %). Er waren geen intraprocedurele myocardinfarcten in de onmiddellijke PCI-groep, terwijl dat er in de gefaseerde PCI-groep 12 waren.6 Hier moet echter wel rekening worden gehouden met een mogelijke steekproefbias in de onmiddellijke PCI-groep waar het moeilijk kan zijn om periprocedurele myocardinfarcten te herkennen (gezien reedse aanwezigheid van symptomen, alsook ST-afwijkingen op ecg). Ook was er een verschil in urgente, ongeplande ischemie-gedreven revascularisatie, waarbij er een significant lager risico was in de onmiddellijke PCI-groep (4,1 % vs. 9,3 %).6 Uiteraard moet hier wel worden opgemerkt dat het gaat om een openlabel design, waarbij zowel de patiënt als de arts op de hoogte was dat er nog onbehandelde significante coronaire letsels aanwezig waren en dat dit mogelijks voor een versnelde doorverwijzing naar de dienst Spoedgevallen zorgde.
Als algemene conclusie kunnen we stellen dat er in de nieuwe ESC-richtlijnen voor behandeling van ACS een klasse I-indicatie bestaat voor complete revascularisatie in hemodynamisch stabiele patiënten met een STEMI en meertakslijden, ofwel onmiddellijk tijdens de indexprocedure, ofwel binnen de 45 dagen, waarbij onmiddellijke PCI minstens even veilig is. De beslissing tussen onmiddellijke PCI van niet-oorzakelijke letsels vs. gefaseerde PCI moet worden geïndividualiseerd en is eveneens afhankelijk van logistieke overwegingen. Daarnaast biedt de MULTISTARS AMI-trial ook enige evidentie voor een voordeel van routine, onmiddellijke PCI tijdens indexprocedure in vergelijking met gefaseerde PCI van niet-oorzakelijke coronaire letsels. Deze trial was echter methodologisch opgesteld om non-inferioriteit aan te tonen, dus de auteurs benadrukken dat ze geen grote uitspraken willen doen over eventuele superioriteit van onmiddellijke complete revascularisatie. Om dit voordeel onomstotelijk aan te tonen, zal bijkomend prospectief onderzoek noodzakelijk zijn.
Referenties
- Sorajja, P., Gersh, B.J., Cox, D.A., McLaughlin, M.G., Zimetbaum, P., Costantini, C. et al. Impact of multivessel disease on reperfusion success and clinical outcomes in patients undergoing primary percutaneous coronary intervention for acute myocardial infarction. Eur Heart J, 2007, 28 (14), 1709-1716.
- Mehta, S.R., Wood, D.A., Storey, R.F., Mehran, R., Bainey, K.R., Nguyen, H. et al. Complete Revascularization with Multivessel PCI for Myocardial Infarction. N Engl J Med, 2019, 381 (15), 1411-1421.
- Neumann, F.J., Sousa-Uva, M., Ahlsson, A., Alfonso, F., Banning, A.P., Benedetto, U. et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J, 2019, 40 (2), 87-165.
- Ibanez, B., James, S., Agewall, S., Antunes, M.J., Bucciarelli-Ducci, C., Bueno, H. et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J, 2018, 39 (2), 119-177.
- Stähli, B.E., Varbella, F., Schwarz, B., Nordbeck, P., Felix, S.B., Lang, I.M. et al. Rationale and design of the MULTISTARS AMI Trial: A randomized comparison of immediate versus staged complete revascularization in patients with ST-segment elevation myocardial infarction and multivessel disease. Am Heart J, 2020, 228, 98-108.
- Stähli, B.E., Varbella, F., Linke, A., Schwarz, B., Felix, S.B., Seiffert, M. et al. Timing of Complete Revascularization with Multivessel PCI for Myocardial Infarction [published online ahead of print, 2023 Aug 27]. N Engl J Med, 2023, 10.1056/NEJMoa2307823.
- Secemsky, E.A., Butala, N., Raja, A., Khera, R., Wang, Y., Curtis, J.P. et al. Temporal Changes and Institutional Variation in Use of Percutaneous Coronary Intervention for ST-Elevation Myocardial Infarction With Multivessel Coronary Artery Disease in the United States: An NCDR Research to Practice Project. JAMA Cardiol, 2021, 6 (5), 574-580.
- Byrne, R.A., Rossello, X., Coughlan, J.J., Barbato, E., Berry, C., Chieffo, A. et al. 2023 ESC Guidelines for the management of acute coronary syndromes [published online ahead of print, 2023 Aug 25]. Eur Heart J, 2023, ehad191.
- Wald, D.S., Morris, J.K., Wald, N.J., Chase, A.J., Edwards, R.J., Hughes, L.O. et al. Randomized trial of preventive angioplasty in myocardial infarction. N Engl J Med, 2013, 369 (12), 1115-1123.
- Engstrøm, T., Kelbæk, H., Helqvist, S., Høfsten, D.E., Kløvgaard, L., Holmvang, L. et al. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3—PRIMULTI): an openlabel, randomised controlled trial. The Lancet, 2015, 386 (9994), 665-671.
- Gershlick, A.H., Khan, J.N., Kelly, D.J., Greenwood, J.P., Sasikaran, T., Curzen, N. et al. Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease: the CvLPRIT trial. J Am Coll Cardiol, 2015, 65 (10), 963-972.
- Smits, P.C., Abdel-Wahab, M., Neumann, F.J., Boxma-de Klerk, B.M., Lunde, K., Schotborgh, C.E. et al. Fractional Flow Reserve-Guided Multivessel Angioplasty in Myocardial Infarction. N Engl J Med, 2017, 376 (13), 1234-1244.
- Diletti, R., den Dekker, W.K., Bennett, J., Schotborgh, C.E., van der Schaaf, R., Sabaté, M. et al. Immediate versus staged complete revascularisation in patients presenting with acute coronary syndrome and multivessel coronary disease (BIOVASC): a prospective, open-label, non-inferiority, randomised trial. The Lancet, 2023, 401 (10383), 1172-1182.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.