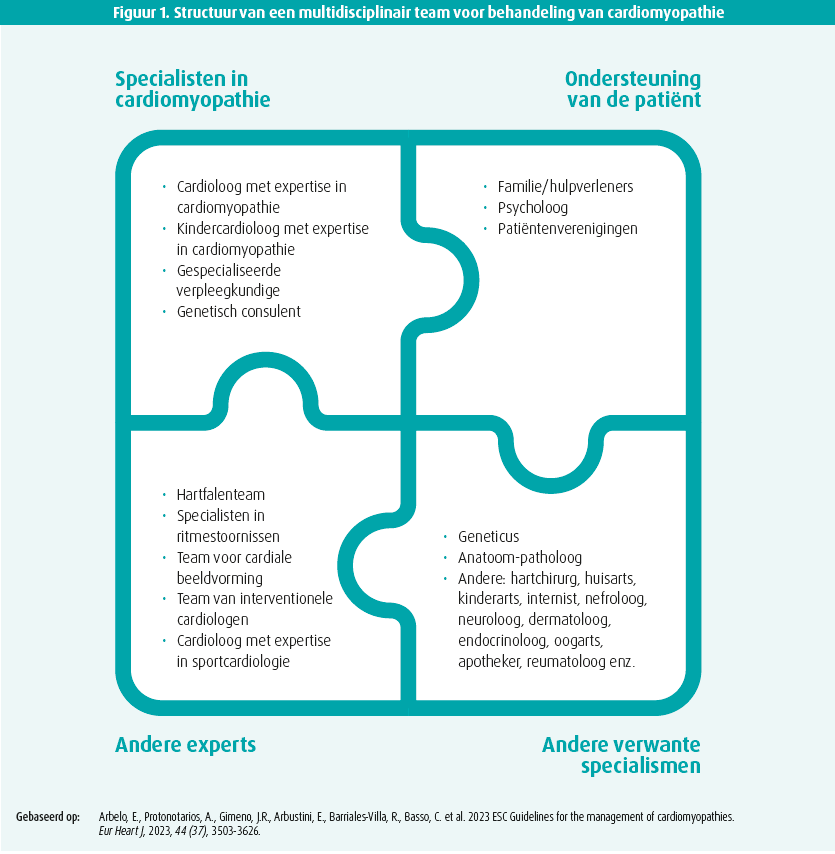
Hypertrofische cardiomyopathie (HCM) is een ziekte van de hartspier die wordt gekenmerkt door myocardiale hypertrofie, hoofdzakelijk van het linkerventrikel (LV), soms van het rechterventrikel of beide ventrikels, zonder andere cardiale, systemische of metabole oorzaak.1-3 Men stelt die diagnose dus bij een patiënt met een linkerventrikelhypertrofie zonder abnormale belasting of infiltratieve ziekte, samen met een wisselende mate van fibrose, afwijkingen van het mitralisklepapparaat, afwijkingen van de microcirculatie en elektrische en echocardiografische afwijkingen.1-3 Bij volwassenen spreken we van HCM als het myocard in een of meer segmenten dikker is dan 15 mm (of 13 mm in geval van een positieve familiale voorgeschiedenis, extracardiale verschijnselen, ecg-afwijkingen, abnormale laboratoriumbevindingen of suggestieve tekenen bij multimodale beeldvorming).2,3 Bij kinderen spreken we over HCM als het myocard dikker is dan twee standaarddeviaties van de normale waarden voor de leeftijd en het geslacht.1-3 Multimodale beeldvorming en genetisch onderzoek nemen een centrale plaats in bij de diagnosestelling. Deze patiënten vergen een totaalaanpak door een multidisciplinair team, dat ook andere disciplines dan cardiologie, beeldvorming en genetica omvat (figuur 1).3 Bij diagnose is het belangrijk een onderscheid te maken tussen andere aandoeningen (fenokopieën) zoals stapelingsziekten, hypertrofie door hemodynamische overbelasting, ziekte van Fabry en neuromusculaire aandoeningen.
HCM is frequent. De prevalentie wordt geraamd op 1/200 tot 1/500. De klinische expressie kan heel uiteenlopend zijn, gaande van asymptomatisch tot hartfalen, syncope, pijn op de borst, ritmestoornissen (frequente oorzaak van morbiditeit bij deze patiënten) en plotse dood, soms het eerste teken van de aandoening.1-3
Sarcomeermutaties veroorzaken, onafhankelijk van hemodynamische belasting, structurele afwijkingen van het myocardweefsel met desorganisatie van de vezels (cardiac disarray), hypertrofie van de myocardcellen en fibrose, waarvan de omvang zeer variabel kan zijn.4 Dit leidt finaal tot een kleine, stijve ventrikel met gestoorde systolische en diastolische functie ondanks een bewaarde LV-ejectiefractie. Anderzijds lijken niet alle klinische manifestaties bij HCM-patiënten toe te schrijven aan sarcomeermutaties. Bepaalde essentiële componenten van het HCM-fenotype hebben geen gekende directe associatie met sarcomeervarianten, zoals het abnormaal intramuraal verloop van coronairen, verantwoordelijk voor small vessel ischemie, geëlongeerde leaflets van de mitraalklep, en anatomische afwijkingen van de papillairspieren. HCM-patiënten ervaren ook ritmestoornissen. Ventriculaire ritmestoornissen kunnen leiden tot plotse dood, met name bij jongeren (belangrijkste oorzaak van plotse dood bij sporters). Supraventriculaire ritmestoornissen zijn eveneens frequent. Voorkamerfibrillatie houdt een verhoogd risico op ischemische beroerte in. Het klinische spectrum omvat dus hartfalen, ritmestoornissen, syncope, plotse dood, kleplijden en pijn op de borst, geassocieerd met een hoge morbiditeit en mortaliteit.
Hypertrofische obstructieve cardiomyopathie
LV-obstructie is een frequente complicatie van HCM, waarbij dan gesproken wordt over hypertrofische obstructieve cardiomyopathie (HOCM). Een obstructie wordt gedefinieerd als een echocardiografische gradiënt van meer dan 30 mmHg.3 We spreken over een significante gradiënt (waarvoor dus een behandeling gewettigd kan zijn) als die groter is dan 50 mmHg, hetzij in rust, hetzij bij provocatie (valsalvamanoeuvre) of bij een inspanning.1-3 De anatomische locatie van de obstructie kan variëren, maar meestal betreft het de uitstroombaan van het LV. Die vorm is dan grotendeels toe te schrijven aan aspiratie van het voorste leaflet van de mitralisklep tijdens de systole als gevolg van septale LVH, maar ook van anatomische afwijkingen en afwijkingen van de inplanting van de chordae tendineae en de papillairspieren van de mitralisklep. De obstructie kan ook lager intraventriculair gelegen zijn en is dan over het algemeen toe te schrijven aan een ernstige hypertrofie en soms aan afwijkingen van de inplanting van de chordae tendineae en de papillairspieren van de mitralisklep.1-3 Circa 50-60 % van de patiënten vertoont een obstructie (in Amerikaanse reeksen was dat tot 75 %).5 Die obstructie kan reeds aanwezig zijn in rust (bij circa 30 % van de patiënten), of wordt gedetecteerd bij een provocatieproef (valsalvamanoeuvre of inspanningsechocardiografie) die dan de resterende 30 % detecteert. Bij de evaluatie van de patiënten moet men dus stelselmatig een provocatieproef uitvoeren (figuur 2). Een obstructie is immers een ongunstig element en is geassocieerd met meer hartfalensymptomatologie, een hoger risico op syncope, een hoger risico op ischemie, meer ritmestoornissen en een risico op plotse dood.
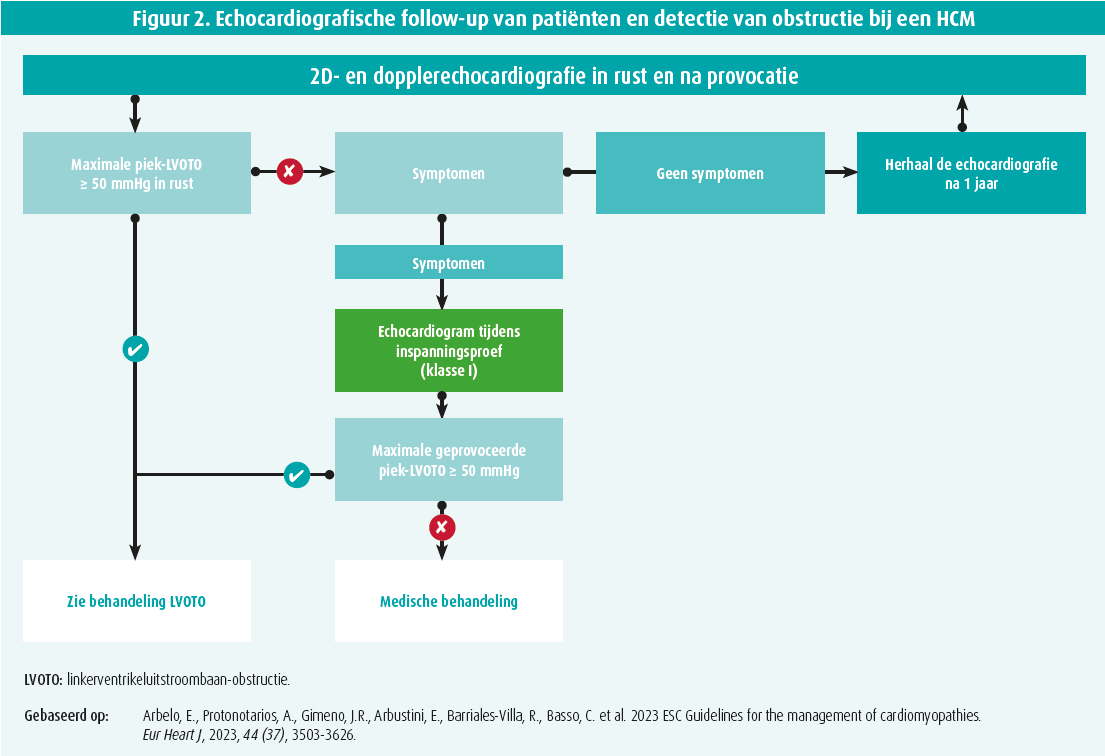
In de praktijk is het dus aanbevolen een obstructie op te sporen bij alle patiënten met een symptomatische HCM, door middel van een echocardiografie in rust en na provocatie als er geen obstructie wordt gezien in rust. De diagnostische drempel is 50 mmHg (richtlijn klasse I-B).1,2 Bij asymptomatische patiënten kan men ook naar een obstructie zoeken, volgens dezelfde modaliteiten, om complicaties als gevolg van een toename van de belasting van het LV te voorkomen (IIa-C).1,2
Behandeling van de obstructie bij HCM
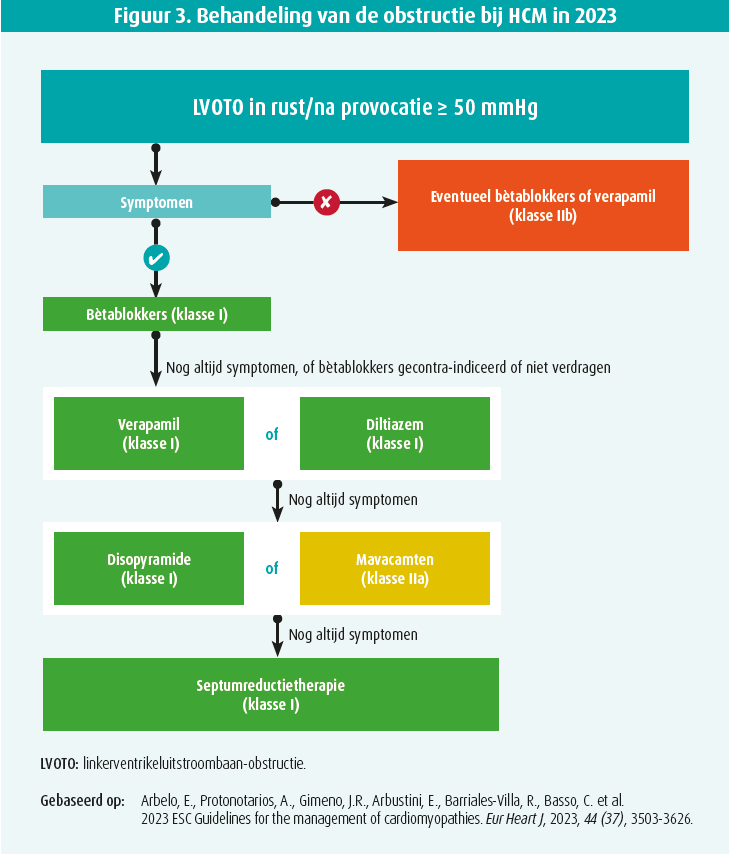
De behandeling van obstructie bestaat uit:1-3
- Niet-farmacologische maatregelen: uitdroging en intense en hevige inspanningen vermijden, geen alcohol drinken en vermageren indien nodig;
- Vermijden van vaatverwijdende geneesmiddelen: dus de meeste antihypertensiva, nitraten en fosfodi-esteraseremmers (IIa-C);
- De patiënten in sinusritme houden of, als dat niet lukt, een betere controle van het kamerantwoord om een betere vulling van het LV te verkrijgen (IIa-C);
- Toediening van geneesmiddelen die de hartfrequentie verlagen of een negatief inotroop effect hebben. Dit verbetert de vulling van het LV (doordat de diastole langer wordt) en vermindert de contractiliteit (negatief inotroop effect), in deze categorie vallen:
- Niet-vaatverwijdende bètablokkers: zij vormen de basis van de behandeling van patiënten met een HCM, vooral patiënten met een HOCM (I-B);3
- Niet-dihydropyridinecalciumantagonisten (verapamil of diltiazem): zij kunnen het effect van bètablokkers versterken (als die laatste in monotherapie niet volstaan en voor zover de bloeddruk en de hartfrequentie dat toelaten), of men kan ze ook voorschrijven in plaats van bètablokkers (als de patiënt die slecht verdraagt) (I-B);3
- Disopyramide: een klasse IA-antiaritmicum met een negatief inotroop effect, dat men ook samen met bètablokkers (of minder vaak calciumantagonisten) kan voorschrijven (I-B).3 Disopyramide verlengt het QT-interval en kan hypotensie en anticholinerge bijwerkingen (droge ogen, urineretentie, constipatie) veroorzaken, wat het gebruik ervan in de dagelijkse praktijk bemoeilijkt (I-B).3 Disopyramide wordt in België dan ook zeer weinig gebruikt; het is bovendien niet goedgekeurd in deze indicatie;
- Mavacamten: een nieuwe selectieve allosterische remmer van de cardiale myosine die door remming van het ATPase van myosine de contractiliteit van het myocard vermindert. Het APTase van myosine leidt tot de vorming van te veel actine-myosinebruggen. Via dit originele werkingsmechanisme ontspant mavacamten (de eerste telg van een nieuwe klasse geneesmiddelen) het myocard. Het grijpt in op het pathofysiologische mechanisme dat aan de grondslag ligt van HCM en de daarmee samenhangende hypercontractiliteit. De werkzaamheid en de veiligheid van mavacamten zijn eerst onderzocht in de fase 2-studie PIONEER.6 Daarna hebben de studies EXPLORER-HCM7, een fase 3-studie, en VALOR8,9 de klinische werkzaamheid ervan bij HOCM aangetoond. Te oordelen naar die resultaten leent mavacamten zich bijzonder goed om de functionele toestand van de patiënten te verbeteren en de intracavitaire drukgradiënt te verlagen. Mavacamten is momenteel geïndiceerd in aanvulling op de bestaande behandelingen om de behoefte aan die laatste te verlagen, en kan een alternatief zijn voor septumreductietherapie.
In de fase 2-studie PIONEER6 hebben de patiënten mavacamten gekregen na stopzetting van bètablokkers, calciumantagonisten en disopyramide (cohorte A) of naast een behandeling met bètablokkers (cohorte B). Die studie is uitgevoerd in Amerikaanse centra bij 21 patiënten (11 in cohorte A en 10 in cohorte B). In de PIONEER-studie verlaagde mavacamten de gradiënt na inspanning in de uitstroombaan van het LV met gemiddeld 89 mmHg in cohorte A (van 103 mmHg, dus een daling van 82 %) en met 25 mmHg in cohorte B (van 86 mmHg, dus een daling van 29 %). De onderzoekers hebben dit effect waargenomen zowel bij patiënten met als zonder mutaties van de sarcomeren. Dat wijst erop dat mavacamten doeltreffend is bij een brede waaier van patiënten met HOCM. In die fase 2-studie had mavacamten ook een gunstig effect op de PvO2, de functionele NYHA-klasse (daling met één niveau) en het NT-proBNP-gehalte.
In de fase 3-studie EXPLORER-HCM7 had mavacamten en gunstig klinisch effect bij symptomatische patiënten met een HOCM (NYHA II-III en LVEF > 55 %). Er werd gestart met een dosis van 5 mg en werd daarna aangepast (2,5; 5; 10 of 15 mg) in functie van de linkerventrikelejectiefractie (LVEF) en de evolutie van de gradiënt. Mavacamten verlaagde de gradiënt in de LVOT gedurende 30 weken en verbeterde de functionele toestand van de patiënten. Het aantal patiënten bij wie de PvO2 met meer dan 1,5 ml/kg/min. verbeterde en de NYHA-klasse met minstens één niveau daalde of bij wie de PvO2 met meer dan 3 ml/kg/ min. verbeterde zonder stijging van de NYHA-klasse, bedroeg 37 % met mavacamten en 17 % in de placebogroep (p = 0,005). Bij 20 % van de patiënten verbeterde de NYHA-klasse met meer dan één niveau én verbeterde de PvO2 met meer dan 3 ml/kg/min. (tegenover 8 % van de patiënten in de placebogroep, p = 0,0005). In de EXPLORER-HCM-studie verbeterde de functionele toestand en daalde de maximale gradiënt na inspanning significant (daling van 47 mmHg in de mavacamtengroep en een daling van 10 mmHg in de placebogroep; p < 0,0001). De gradiënt in rust of tijdens een valsalvamanoeuvre verbeterde significant. De inname van mavacamten verbeterde ook de levenskwaliteit gemeten via de KCCQ-12 clinical summary score, verminderde het gevoel van kortademigheid (verbetering van de HCMSQ-SoB-score) en verlaagde de plasmaconcentraties van NT-proBNP en cTnI. Een interessante vaststelling is verder dat het aantal bijwerkingen niet hoger was in de mavacamtendan in de placebogroep. Bij een klein aantal patiënten daalde de LVEF transiënt, maar die herstelde weer na verlaging van de dosering. Het is dan ook wenselijk om de LVEF te controleren tijdens toediening van mavacamten. De extensiestudie MAVA-LTE verzamelt momenteel gegevens op lange termijn, en die blijken de resultaten van de initiële studie te bevestigen;
Een zeer interessante vaststelling is dat in de MRI-substudie van EXPLORER-HCM de inname van mavacamten correleerde met een vermindering van de spiermassa en de maximale dikte van de LV-wand en een daling van het volume van de linkervoorkamer. Dat zou erop kunnen wijzen dat mavacamten een direct effect heeft op de hartspier, of dat de daling van de intraventriculaire drukken een gunstige invloed heeft op de remodellering en de fibrose van de ventrikelwand;10
- Septumreductietherapie: chirurgische myectomie met of zonder mitralisklepplastie of septumreductie door percutane injectie van alcohol in het septum. Deze technieken zijn geïndiceerd bij patiënten met een significante residuele gradiënt (> 50 mmHg in rust of na provocatie) en symptomen (NYHA II-IV, syncope tijdens of na inspanning, SAM en secundaire mitralisklepinsufficiëntie) ondanks een maximale medicamenteuze behandeling (met de maximale dosering die de patiënt nog verdraagt). Gezien de mogelijke complicaties van septumreductie en de vereiste technische expertise mogen enkel expertisecentra die twee procedures (chirurgie en alcoholisatie) uitvoeren na een grondige evaluatie van de patiënt voor precieze bepaling van het niveau en het mechanisme van de obstructie. Het onderzoek omvat een volledige evaluatie van de betrokken structurele afwijkingen (ook van de klep). Zo niet dreigt de procedure vergeefs of onvoldoende te zijn. Ook moet een evaluatie van het risico op ventriculaire ritmestoornissen en plotse dood worden gemaakt;
- Voor chirurgie: het slaagpercentage op lange termijn bedraagt 70-80 %. De resultaten zijn het best bij mannen jonger dan 50 jaar in sinusritme en een weinig verwijde linkervoorkamer (< 46 mm). Zo nodig (10-20 % van de patiënten) kan de chirurg dan ook de mitralisklep behandelen. Complicaties zijn AV-geleidingsstoornissen (bij 10-15 % van de patiënten, waarvoor de inplanting van een pacemaker vereist is), een ventrikelseptumdefect (VSD) en secundaire aorta-insufficiëntie;
- Voor septale myectomie: het slaagpercentage hangt af van de aan- of afwezigheid van een septale tak van de LAD. In voorkomend geval kan men alcohol inspuiten in het proximale interventriculaire septum, wat een fibreus litteken in die sector veroorzaakt. Het is een zeer delicate ingreep (vooral de beslissing over de tak en het te injecteren volume alcohol). Dat verklaart waarom het slaagpercentage erg wisselend is. De alcohol veroorzaakt necrose, maar er kan te veel of te weinig necrose optreden. Dat kan dan weer leiden tot complicaties zoals geleidingsstoornissen, perforatie van het septum en ritmestoornissen. Als de septale alcoholisatie wordt uitgevoerd in expertisecentra met een groot volume aan dergelijke procedures en onder echocardiografische controle met injectie van contrast (en enkel onder die voorwaarden), ligt het slaagpercentage vrij dicht bij dat van chirurgie. De belangrijkste complicaties van de ingreep zijn AV-geleidingsstoornissen (tot 20 % van de patiënten), een bundeltakblok en ventriculaire ritmestoornissen.
In de VALOR-HCM-studie9 hebben de vorsers onderzocht of mavacamten boven op de maximale getolereerde medische behandeling met bètablokkers, calciumantagonisten en disopyramide de noodzaak tot septumreductietherapie bij patienten met een symptomatische HOCM verlaagt. Het aantal patiënten dat na 16 weken in aanmerking kwam voor septumreductietherapie bedroeg 17 % in de mavacamtengroep en 76 % in de controlegroep, dus een significante daling van de noodzaak tot septumreductie. Na 32 weken kwam slechts 10 % van de patiënten van de mavacamtengroep in aanmerking voor septumreductie.8 In de VALOR-studie daalde de gradiënt in de LVOT na inspanning significant en verbeterde de functionele klasse bij meer dan 80 % van de patiënten. Die gegevens bevestigen de klinische werkzaamheid van mavacamten en onderstrepen de beperkingen van een behandeling met enkel een bètablokker, een calciumantagonist en disopyramide. Dankzij mavacamten zal de noodzaak tot septumreductietherapie allicht dalen.
- Ventriculaire pacing: dit wordt weinig gebruikt om obstructie te behandelen. Pacing is minder effectief dan septum reductie, maar blijft een optie bij patiënten die een pacemaker nodig hebben om een andere reden.
Rekening houdend met de beschikbare geneesmiddelen en mechanische technieken stellen de richtlijnen een medische behandeling als eerstelijnstherapie voor bij een symptomatische obstructie. Die bestaat uit bètablokkers (en/of calcium antagonisten, naargelang het profiel en de respons van de patiënt). Disopyramide en mavacamten vormen een tweedelijnstherapie en zijn geïndiceerd als de obstructie onvoldoende onder controle komt (IIa-A) (figuur 3). In de uitzonderlijke gevallen waar de pa tiënt noch bètablokkers noch calciumantagonisten noch disopyramide verdraagt, zou men mavacamten in monotherapie kunnen voorschrijven (IIa-B).3 Men moet de dosering van het geneesmiddel of de combinatie van medicamenten regelmatig aanpassen tot de maximale dosering die de patiënt verdraagt. Septumreductietherapie is enkel geïndiceerd bij patiënten die onvoldoende reageren op de medische behandeling. Gezien de resultaten van de VALOR-studie9 is het plausibel dat er steeds minder vaak zal worden overgegaan tot septumreductie.
Conclusie
HCM is frequent en erg complex. De behandeling van symptomatische HCM is een nieuw tijdperk ingetreden met de ontwikkeling van een nieuwe klasse van geneesmiddelen die specifiek de actine-myosinebruggen van de hartspier inhiberen en dus ingrijpen op het pathofysiologische mechanisme dat ten grondslag ligt aan de hypertrofie. Mavacamten is het eerste geneesmiddel dat de obstructie en de functionele toestand van de patiënt verbetert. Gezien zijn werkingsmechanisme is het mogelijk dat mavacamten gunstige effecten heeft op de remodellering van het myocard, de fibrose en de hypertrofie. Het kan m.a.w. veel bredere klinische effecten hebben. Momenteel lopen er verschillende klinische studies om dat te evalueren (o.a. de studies ODYSSEY-HCM en MEMENTO).
Referenties
- Ommen, S. R., Mital, S., Burke, M.A., Day, S.M., Deswal, A., Elliot, P. et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: Executive Summary. Circulation, 2020, 142 (25), e558-e631.
- Elliott, P.M., Anastasakis, A., Borger, M.A., Borggrefe, M., Cecchi, F., Charron, P. et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J, 2014, 35 (39), 2733-2779.
- Arbelo, E., Protonotarios, A., Gimeno, J.R., Arbustini, E., Barriales-Villa, R., Basso, C. et al. 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J, 2023, 44 (37), 3503-3626.
- Spudich, J. A. Hypertrophic and dilated cardiomyopathy: four decades of basic research on muscle lead to potential therapeutic approaches to these devastating genetic diseases. Biophys J, 2014, 106 (6), 1236-1249.
- Maron, M. S., Olivotto, l., Zenovich, A.G., Link, M.S., Pandian, N.G., Kuvin, J.T. et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation, 2006, 114 (21), 2232-2239.
- Heitner, S. B., Jacoby, D., Lester, S.J., Owens, A., Wang, A., Zhang, A.D. et al. Mavacamten Treatment for Obstructive Hypertrophic Cardiomyopathy: A Clinical Trial. Ann Intern Med, 2019, 170 (11), 741-748.
- Olivotto, I., Oreziak, A., Barriales-Villa, R., Abraham, T.P., Masri, A. Garcia-Pavia, P. et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet, 2020, 396 (10253), 759-769.
- Desai, M. Y., Owens, A., Geske, J.B., Wolski, K., Saberi, S., Wang, A. et al. Dose-Blinded Myosin Inhibition in Patients with Obstructive HCM Referred for Septal Reduction Therapy: Outcomes Through 32-Weeks. Circulation, 2022, 147, 850-863.
- Desai, M. Y., Owens, A., Geske, J.B., Wolski, K., Naidu, S.S., Smedira, N.G. et al. Myosin Inhibition in Patients With Obstructive Hypertrophic Cardiomyopathy Referred for Septal Reduction Therapy. J Am Coll Cardiol, 2022, 80 (2), 95-108.
- Saberi, S., Cardim, N., Yamani, M., Schulz-Menger, J., Li, W., Florea, V. et al. Mavacamten Favorably Impacts Cardiac Structure in Obstructive Hypertrophic Cardiomyopathy: EXPLORER-HCM Cardiac Magnetic Resonance Substudy Analysis. Circulation, 2021, 143 (6), 606-608.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.