Mitralisklepprolaps: epidemiologie en klinische uitkomst
Mitralisklepprolaps (MVP) is een frequente aandoening met een prevalentie van 2-3 %.1, 2 en is de belangrijkste oorzaak van primaire mitralisinsufficiëntie (MI) in de westerse wereld.3 Het wordt gedefinieerd als een systolische verplaatsing van ≥ 2 mm van minstens één klepblad voorbij de mitralisannulus richting het linkeratrium. De ziekte van Barlow is de meest gekende oorzaak van MVP en ontstaat door myxomateuze degeneratie met een diffuse toename van de hoeveelheid proteoglycanen in de pars spongiosa van de mitralisklep.4, 5 Fibro-elastische deficiëntie en andere fruste vormen worden daarentegen gekenmerkt door een deficit van extracellulaire componenten in een beperkt aantal segmenten en komen meestal op oudere leeftijd voor.6 Tot slot wordt MVP ook vaak gezien bij genetische aandoeningen zoals het syndroom van Marfan.
Initieel werd MVP beschouwd als een benigne fenomeen. In 1999 publiceerden Freed et al. epidemiologische data gebaseerd op de Framingham Heart-studie.2, 7 De prevalentie van complicaties (voorkamerfibrillatie, iCVA en syncope) bleek laag en vergelijkbaar met participanten zonder MVP. De groep met MVP was echter klein (84 patiënten) en had gemiddeld slechts een milde MI. De sporadisch geassocieerde symptomen (atypische retrosternale pijn, palpitaties, een midsystolische klik bij auscultatie) werden samen het MVP-syndroom genoemd.8
Prospectieve trials in het begin van de jaren 2000 concludeerden dat de prognose van MVP bepaald wordt door de ernst van regurgitatie.4, 9, 10 Het EROA (effectief regurgiterend orificiumoppervlakte) bleek een belangrijke onafhankelijke predictor voor mortaliteit.9 Patiënten met een asymptomatische, medicamenteus behandelde ernstige MI (EROA > 40 mm2) hadden een slechtere prognose dan patiënten met milde regurgitatie (EROA < 20 mm2). De echocardiografische kwantificatie is dan ook de hoeksteen in de stratificatie, follow-up en besliskunde tot interventie volgens de internationale richtlijnen.11
Ontstaan van het concept 'aritmogene MVP'
Hoewel men had aangetoond dat de ernst van de MI en linkerventrikeldisfunctie de primaire prognostische determinanten zijn, waren er daarvoor reeds beschrijvingen van maligne ventriculaire aritmieën (VA) en plotse hartdood bij MVP met verwaarloosbare MI.12, 13 In een case series van de Mayo Clinic werden bileaflet MVP, vrouwelijk geslacht, ecg met negatieve T-toppen en frequente ventriculaire ectopie geïdentificeerd als risicofactoren voor plotse hartdood.13
Basso et al. herevalueerden in 2015 de prognose van MVP en beschreef de entiteit 'aritmogene MVP' als een ondergerapporteerde risicofactor voor plotse hartdood.5 In een retrospectieve autopsiestudie van Noord-Italië werd MVP vastgesteld bij 7 % van de 650 patiënten die plots overleden waren, wat overeenkomt met 46 patiënten, waarvan 26 vrouwen en met een gemiddelde leeftijd van 32 jaar. Complexe VA werden pre-mortem bij 30 patiënten gedocumenteerd. Pathologisch onderzoek in combinatie met late gadolinium enhancement op MRI toonde fibrose ter hoogte van de papillaire spieren (100 %) en de inferobasale LV-wand (88 %). Verder MRI-onderzoek toonde aan dat specifieke morfologische kenmerken binnen de heterogene groep van MVP geassocieerd waren met de ontwikkeling van fibrose, namelijk bileaflet prolaps, curling van het posterieure klepblad, basale LV-hypertrofie, een gedilateerde mitralis annulus en mitralis-annulusdisjunctie (MAD).14 Het Pickelhaube sign op tissue doppler is een scherp signaal van > 16 cm/s van de laterale mitralis annulus en is een teken van toegenomen tractie op die plaats.15
De hypothese was dat MVP een continue mechanische stretch van het myocard veroorzaakt tijdens systole, wat leidt tot lokale cardiomyocyte hypertrofie in een eerste fase, en vervolgens fibreuze omvorming.5, 14 Dit anatomische substraat zou het myocard elektrisch instabiel maken en een risicofactor zijn voor plotse hartdood. Hiermee besloten de auteurs dat het verloop van MVP niet altijd benigne is en benadrukten ze het verhoogde risico op plotse hartdood bij jonge patiënten. Belangrijke limitaties van deze studies zijn het retrospectieve karakter en de zeer geselecteerde patiëntenpopulatie, waardoor het moeilijk is correcte conclusies te maken omtrent de definitie, pathofysiologie en het nut van (preventieve) behandeling bij het 'maligne MVP-syndroom'.
Mitralis-annulusdisjunctie
Een morfologische entiteit die de laatste jaren veel aandacht kreeg is MAD.5, 14, 16 MAD werd voor het eerst beschreven in de jaren tachtig.16, 17 De disjunctie is een macroscopische scheiding tussen de aanhechting van het achterste mitralisklepblad op de linkeratriale wand en de basis van het linkerventrikel18 (figuur 1). Een grootschalige autopsiestudie toonde een correlatie aan tussen MVP en MAD.16 Na jaren van stilte verschenen er plots meerdere retrospectieve studies die een associatie met complexe VA suggereerden. Carmo et al. beschreven de detectie van MAD op echografie bij 55 % van de patiënten met MVP en zagen een lineaire correlatie tussen de mate van disjunctie en het optreden van VA.18 Men veronderstelde dat de mate van disjunctie gelinkt is met ventriculaire ectopie, waarbij > 8 mm prognostisch ongunstig zou zijn in de aMVP-populatie.14, 18
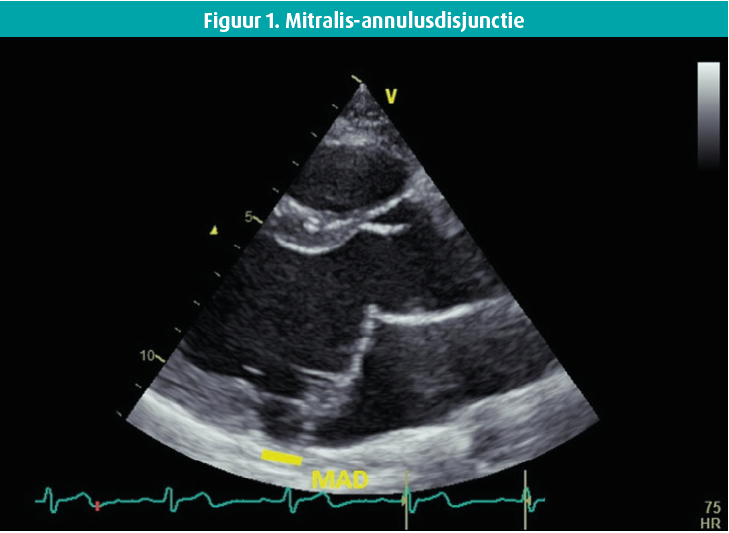
De klinische significantie was echter onzeker in afwezigheid van grote prospectieve studies. Tot op heden blijft het onduidelijk of MAD een causaal verband heeft met VA en of bepaalde genetische factoren een rol spelen.19 Verder bleek MAD ook in een gezonde populatie zonder MVP een frequente toevalsvondst te zijn op CT-scan.21 De kleine gemiddelde afstand van disjunctie in deze studie illustreert dat MAD een continue variabele is en dat we een cut-off nodig hebben om normale anatomie te onderscheiden van pathologische MAD. Bovendien kaartten Faletra et al. de overdiagnostiek van MAD aan. Via MRI toonden ze dat een belangrijk deel van de MVP-patiënten met zogenaamde MAD in feite 'pseudo-MAD' heeft waarbij de anatomische insertie correct is, maar we in systole een foute inschatting krijgen door juxtapositie van het prolaberende achterste klepblad en de atriale wand.20
Prognose van MAD, MVP en aMVP
De grootste prospectieve data over de prognostische betekenis van MAD werden verzameld in de Mayo Clinic, waar 595 patiënten met MVP gedurende een decennium werden gevolgd.23 De diagnose van MAD werd gesteld in 30 % van de patiënten en kwam typisch voor bij het fenotype van aMVP met leaflet redundancy en bileaflet prolaps. De gemiddelde lengte van MAD bedroeg 7,5 mm. Hoewel MAD onafhankelijk geassocieerd bleek met het optreden van VA, werd de tienjaarsmortaliteit niet beïnvloed in vergelijking met MVP zonder MAD.23, 24
Het jaarlijkse risico op plotse hartdood bij MVP is moeilijk in te schatten maar ligt tussen 0,2 en 0,4 % per jaar waarbij de ernst van het MI de prognose het meest bepaalt.31 Daarnaast is bij de subpopulatie van aMVP het type van VA een zeer belangrijke en tot op heden de enige onafhankelijke predictor voor mortaliteit: uit data van de Mayo Clinic-cohorte blijkt dat de achtjaarsmortaliteit 10 % (± 2 %) bedroeg bij patiënten zonder PVC vs. 17 % ± 3 %) in de groep met VA. De mortaliteit was opvallend hoog in de subgroep met ernstige VA, gedefinieerd als een gedocumenteerde ventriculaire tachycardie > 180/min.24 Prospectieve data over een potentieel overlevingsvoordeel met ICD-implantatie bij patiënten met aMVP ontbreken.
Huidige consensus aMVP en behandeling
Het voorbije decennium werd gekenmerkt door tegenstrijdige gegevens. In een poging om meer duidelijkheid te creëren werd recent een internationaal consensusstatement gepubliceerd door de EHRA.25 Figuur 2 toont het algoritme van de risicostratificatie.
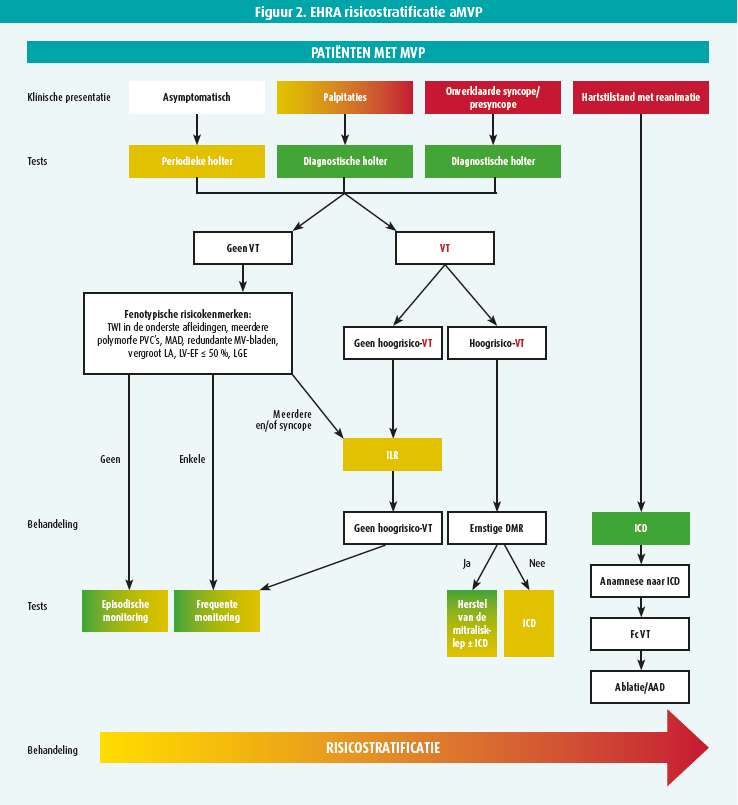
Aritmogene MVP wordt gedefinieerd als een MVP met frequente (> 5 %) en/of complexe VA zonder andere duidelijke etiologie.25 Het morfologische fenotype acht men niet noodzakelijk voor de diagnose. Bij elke patiënt met MVP raadt men aan een grondige anamnese, klinisch onderzoek, echocardiografie en 24 uursholter te doen om te screenen naar risicofactoren voor aMVP. Electrocardiografisch wordt het aMVP-syndroom gekenmerkt door T-golf inversies inferolateraal.26 Ventriculaire ectopie is frequent aanwezig, met predominante oorsprong in de papillaire spieren of mitralisannulus.5, 12-14, 25, 27 Op beeldvorming moet naast de kwantificatie van het MI ook worden gezocht naar MAD, overmatig klepweefsel, bileaflet prolaps en LGE op MRI.23, 25, 29
Bij determinanten voor een hoog risico VA (bv. palpitaties, syncopes, MAD, bileaflet prolaps …) is verlengde ritmemonitoring aangeraden door middel van een zevendagenholter of looprecorder.25 Zo kan men een risicostratificatie maken met als doel de hoogrisico-VA (VT > 180/min) te detecteren.
Preventie van plotse hartdood met een ICD wordt enkel aangeraden bij een gedocumenteerde voorgeschiedenis van plotse hartdood op basis van VF of VT zonder reversibele factoren, of bij een gedocumenteerde symptomatische VT > 180/min. Verder kan een ICD worden overwogen bij een hemodynamisch verdragen (NS)VT > 180/min als er ook nog twee fenotypische criteria aanwezig zijn.25
Er bestaat geen specifieke behandeling voor aMVP. Farmacologische therapie en/of VT-ablatie moet bij elke patiënt met VA worden overwogen, onafhankelijk van het fenotype en in de juiste klinische setting. Het effect van mitralisklepchirurgie op VA werd nog niet bestudeerd, zodat de indicaties voor heelkunde dezelfde zijn als voor primaire MI zonder aritmogeen fenotype.
Conclusie
AMVP is een syndroom gekenmerkt door MVP en VA met een verhoogd risico op plotse hartdood. Een patiënt met kenmerken van aMVP op ecg of beeldvorming verdient intensieve ritmemonitoring, maar profylactische ICD-implantatie wordt niet aangeraden. Documentatie van ernstige VA, gedefinieerd als VT > 180/min, is wel een indicatie voor ICD-plaatsing. De pathofysiologie van aMVP blijft onvolledig opgeklaard. Gerandomiseerde klinische studies zijn nodig om de therapeutische algoritmes te verfijnen.
Referenties
- Delling, F.N., Vasan, R.S. Epidemiology and pathophysiology of mitral valve prolapse: new insights into disease progression, genetics, and molecular basis. Circulation, 2014, 129 (21), 2158-2170.
- Freed, L.A., Levy, D., Levine, R.A., Larson, M.G., Evans, J.C., Fuller, D.L. et al. Prevalence and clinical outcome of mitral-valve prolapse. N Engl J Med, 1999, 341 (1), 1-7.
- Dziadzko, V., Dziadzko, M., Medina-Inojosa, J.R., Benfari, G., Michelena, H.I., Crestanello, J.A. et al. Causes and mechanisms of isolated mitral regurgitation in the community: clinical context and outcome. Eur Heart J, 2019, 40 (27), 2194-2202.
- Avierinos, J.F., Gersh, B.J., Melton, L.J.3rd, Bailey, K.R., Shub, C., Nishimura, R.A. et al. Natural history of asymptomatic mitral valve prolapse in the community. Circulation, 2002, 106 (11), 1355-1361.
- Basso, C., Perazzolo Marra, M., Rizzo, S., De Lazzari, M., Giorgi, B., Cipriani, A. et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation, 2015, 132 (7), 556-566.
- Adams, D.H., Rosenhek, R., Falk, V. Degenerative mitral valve regurgitation: best practice revolution. Eur Heart J, 2010, 31 (16), 1958-1966.
- Mahmood, S.S., Levy, D., Vasan, R.S., Wang, T.J. The Framingham Heart Study and the epidemiology of cardiovascular disease: a historical perspective. Lancet, 2014, 383 (9921), 999-1008.
- Hayek, E., Gring, C.N., Griffin, B.P. Mitral valve prolapse. Lancet, 2005, 365 (9458), 507-518.
- Enriquez-Sarano, M., Avierinos, J.F., Messika-Zeitoun, D., Detaint, D., Capps, M., Nkomo, V. et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med, 2005, 352 (9), 875-883.
- Enriquez-Sarano, M., Basmadjian, A.J., Rossi, A., Bailey, K.R., Seward, J.B., Tajik, A.J. Progression of mitral regurgitation: a prospective Doppler echocardiographic study. J Am Coll Cardiol, 1999, 34 (4), 1137-1144.
- Vahanian, A., Beyersdorf, F., Praz, F., Milojevic, M., Baldus, S., Bauersachs, J. et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2022, 43 (7), 561-632.
- Vohra, J., Sathe, S., Warren, R., Tatoulis, J., Hunt, D. Malignant ventricular arrhythmias in patients with mitral valve prolapse and mild mitral regurgitation. Pacing Clin Electrophysiol, 1993, 16 (3 Pt 1), 387-393.
- Sriram, C.S., Syed, F.F., Ferguson, M.E., Johnson, J.N., Enriquez-Sarano, M., Cetta, F. et al. Malignant bileaflet mitral valve prolapse syndrome in patients with otherwise idiopathic out-of-hospital cardiac arrest. J Am Coll Cardiol, 2013, 62 (3), 222-230.
- Perazzolo Marra, M., Basso, C., De Lazzari, M., Rizzo, S., Cipriani, A., Giorgi, B. et al. Morphofunctional Abnormalities of Mitral Annulus and Arrhythmic Mitral Valve Prolapse. Circ Cardiovasc Imaging, 2016, 9 (8), e005030.
- Muthukumar, L., Rahman, F., Jan, M.F., Shaikh, A., Kalvin, L., Dhala, A. et al. The Pickelhaube Sign: Novel Echocardiographic Risk Marker for Malignant Mitral Valve Prolapse Syndrome. JACC Cardiovasc Imaging, 2017, 10 (9), 1078-1080.
- Hutchins, G.M., Moore, G.W., Skoog, D.K. The association of floppy mitral valve with disjunction of the mitral annulus fibrosus. N Engl J Med, 1986, 314 (9), 535-540.
- Bharati, S., Granston, A.S., Liebson, P.R., Loeb, H.S., Rosen, K.M., Lev, M. The conduction system in mitral valve prolapse syndrome with sudden death. Am Heart J, 1981, 101 (5), 667-670.
- Carmo, P., Andrade, M.J., Aguiar, C., Rodrigues, R., Gouveia, R., Silva, J.A. Mitral annular disjunction in myxomatous mitral valve disease: a relevant abnormality recognizable by transthoracic echocardiography. Cardiovasc ultrasound, 2010, 8, 53.
- Bains, S., Tester, D.J., Asirvatham, S.J., Noseworthy, P.A., Ackerman, M.J., Giudicessi, J.R. A Novel Truncating Variant in FLNC-Encoded Filamin C May Serve as a Proarrhythmic Genetic Substrate for Arrhythmogenic Bileaflet Mitral Valve Prolapse Syndrome. Mayo Clin Proc, 2019, 94 (5), 906-913.
- Faletra, F.F., Leo, L.A., Paiocchi, V.L., Schlossbauer, S.A., Pavon, A.G., Ho, S.Y., Maisano, F. Morphology of Mitral Annular Disjunction in Mitral Valve Prolapse. J Am Soc Echocardiogr, 2022, 35 (2), 176-186.
- Toh, H., Mori, S., Izawa, Y., Fujita, H., Miwa, K., Suzuki, M. et al. Prevalence and extent of mitral annular disjunction in structurally normal hearts: comprehensive 3D analysis using cardiac computed tomography. Eur Heart J Cardiovasc Imaging, 2021, 22 (6), 614-622.
- Dejgaard, L.A., Skjolsvik, E.T., Lie, O.H., Ribe, M., Stokke, M.K., Hegbom, F. et al. The Mitral Annulus Disjunction Arrhythmic Syndrome. J Am Coll Cardiol, 2018, 72 (14), 1600-1609.
- Essayagh, B., Sabbag, A., Antoine, C., Benfari, G., Batista, R., Yang, L.T. et al. The Mitral Annular Disjunction of Mitral Valve Prolapse: Presentation and Outcome. JACC Cardiovasc Imaging, 2021, 14 (11), 2073-2087.
- Essayagh, B., Sabbag, A., Antoine, C., Benfari, G., Yang, L.T., Maalouf, J. et al. Presentation and Outcome of Arrhythmic Mitral Valve Prolapse. J Am Coll Cardiol, 2020, 76 (6), 637-649.
- Sabbag, A., Essayagh, B., Barrera, J.D.R., Basso, C., Berni, A., Cosyns, B. et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. Europace, 2022, 24 (12), 1981-2003.
- Nalliah, C.J., Mahajan, R., Elliott, A.D., Haqqani, H., Lau, D.H., Vohra, J.K. et al. Mitral valve prolapse and sudden cardiac death: a systematic review and meta-analysis. Heart, 2019, 105 (2), 144-151.
- Oliveri, F., Kakargias, F., Panday, P., Arcia Franchini, A.P., Iskander, B., Anwer, F., Hamid, P. Arrhythmic mitral valve prolapse: Diagnostic parameters for high-risk patients: A systematic review and meta-analysis. Pacing Clin Electrophysiol, 2021, 44 (10), 1746-1755.
- Lancellotti, P., Tribouilloy, C., Hagendorff, A., Popescu, B.A., Edvardsen, T., Pierard, L.A. et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging, 2013, 14 (7), 611-644.
- Essayagh, B., Sabbag, A., El-Am, E., Cavalcante, J.L., Michelena, H.I., Enriquez- Sarano, M. Arrhythmic mitral valve prolapse and mitral annular disjunction: pathophysiology, risk stratification, and management. Eur Heart J, 2023, 44 (33), 3121-3135.
- Han, H.C., Ha, F.J., Teh, A.W., Calafiore, P., Jones, E.F., Johns, J. et al. Mitral Valve Prolapse and Sudden Cardiac Death: A Systematic Review. J Am Heart Assoc, 2018, 7 (23), e010584.
- Muthukumar, L., Jahangir, A., Jan, M.F., Perez Moreno, A.C., Khandheria, B.K., Tajik, A.J. Association Between Malignant Mitral Valve Prolapse and Sudden Cardiac Death: A Review. JAMA Cardiol, 2020, 5 (9), 1053-1061.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.