Prolapsus valvulaire mitral : épidémiologie et issue clinique
Le prolapsus valvulaire mitral (PVM) est une affection fréquente, qui connaît une prévalence de 2 à 3 %1, 2, et est la principale cause d'insuffisance mitrale (IM) primaire dans le monde occidental.3 Il est défini comme un déplacement systolique de ≥ 2 mm d'au moins un feuillet valvulaire au-delà du plan de l'anneau mitral, en direction de l'oreillette gauche. La maladie de Barlow est la cause la plus connue de PVM et est due à une dégénérescence myxoïde avec augmentation diffuse des protéoglycanes de la couche spongieuse de la valve mitrale.4, 5 La dégénérescence fibro-élastique et d'autres formes frustes sont, en revanche, caractérisées par un déficit en composants extracellulaires dans un nombre limité de segments et surviennent généralement à un âge plus avancé.6 Enfin, le PVM est aussi souvent observé dans les maladies génétiques telle que le syndrome de Marfan.
Initialement, le PVM était considéré comme un phénomène bénin. En 1999, Freed et al. ont publié des données épidémiologiques basées sur l'étude Framingham Heart.2, 7 La prévalence des complications (fibrillation atriale, AVC ischémique et syncope) s'est avérée faible et comparable avec celle observée parmi les participants sans PVM. Le groupe présentant un PVM était cependant de petite taille (84 patients) et n'avait en moyenne qu'une IM légère. Les symptômes sporadiquement associés (douleur rétrosternale atypique, palpitations, clic mésosystolique à l'auscultation) étaient mentionnés avec le syndrome de PVM.8
Des essais prospectifs menés au début des années 2000 ont conclu que le pronostic du PVM est déterminé par la sévérité de la régurgitation.4, 9, 10 L'EROA (surface de l'orifice effectif régurgitant) s'est avéré un prédicteur indépendant important de la mortalité.9 Le pronostic des patients atteints d'une IM asymptomatique sévère (EROA > 40 mm2), traitée par médicaments, était plus sombre que celui des patients présentant une régurgitation légère (EROA < 20 mm2). La quantification échocardiographique est dès lors la pierre angulaire de la stratification, du suivi et du processus de décision d'intervention conformément aux recommandations internationales.11
Apparition du concept de « PVM arythmogène »
Bien qu'il ait été démontré que la sévérité de l'IM et de la dysfonction ventriculaire gauche sont les déterminants pronostiques principaux, des descriptions d'arythmies ventriculaires (AV) malignes et de mort subite d'origine cardiaque en présence d'un PVM avec IM négligeable avaient déjà été faites précédemment.12, 13 Dans une série de cas de la Mayo Clinic, le PVM des deux feuillets, le sexe féminin, des ondes T négatives à l'ECG et une ectopie ventriculaire fréquente ont été identifiés comme des facteurs de risque de mort subite d'origine cardiaque.13
En 2015, Basso et al. ont réévalué le pronostic de PVM et ont décrit l'entité « PVM arythmogène » comme un facteur de risque sous-rapporté de mort subite d'origine cardiaque.5 Dans une étude rétrospective d'autopsies menée en Italie du Nord, un PVM a été observé chez 7 % des 650 patients décédés subitement, soit 46 patients, dont 26 femmes, d'un âge moyen de 32 ans. Des AV complexes étaient documentées pre-mortem chez 30 patients. L'examen pathologique associé à un rehaussement tardif à l'IRM a montré une fibrose au niveau des muscles papillaires (100 %) et de la paroi inférobasale du ventricule gauche (88 %). De plus amples examens d'IRM ont montré que les caractéristiques morphologiques spécifiques au sein du groupe hétérogène de PVM étaient associées au développement d'une fibrose, à savoir un prolapsus des deux feuillets, un enroulement (curling) du feuillet postérieur, une hypertrophie basale du ventricule gauche, une dilatation de l'anneau mitral et une disjonction annulaire mitrale (DAM).14 Le signe de Pickelhaube au doppler tissulaire est un signal aigu de > 16 cm/s de l'anneau mitral latéral et un signe de traction accrue à cet endroit.15 L'hypothèse était que le PVM provoque un étirement mécanique permanent du myocarde durant la systole, ce qui engendre une hypertrophie locale des cardiomyocytes dans un premier temps, puis une transformation fibreuse.5, 14 Ce substrat anatomique rendrait le myocarde électriquement instable et serait un facteur de risque de mort subite d'origine cardiaque. Les auteurs concluent ainsi que l'évolution du PVM n'est pas toujours bénigne et insistent sur le risque accru de mort subite d'origine cardiaque chez les patients jeunes. Les limitations importantes de ces études sont leur caractère prospectif et la population de patients fortement sélectionnée, de sorte qu'il est impossible de tirer des conclusions correctes en ce qui concerne la définition, la pathophysiologie et l'utilité du traitement (préventif) en cas de « syndrome du PVM malin ».
Disjonction annulaire mitrale
La DAM est une entité morphologique qui a bénéficié d'une grande attention ces dernières années.5, 14, 16 La DAM a été décrite pour la première fois dans les années 1980.16, 17 La disjonction est une séparation macroscopique entre l'attache du feuillet mitral postérieur sur la paroi atriale gauche et la base du ventricule gauche18 (figure 1). Une étude d'autopsies de grande envergure a mis en évidence une corrélation entre le PVM et la DAM.16
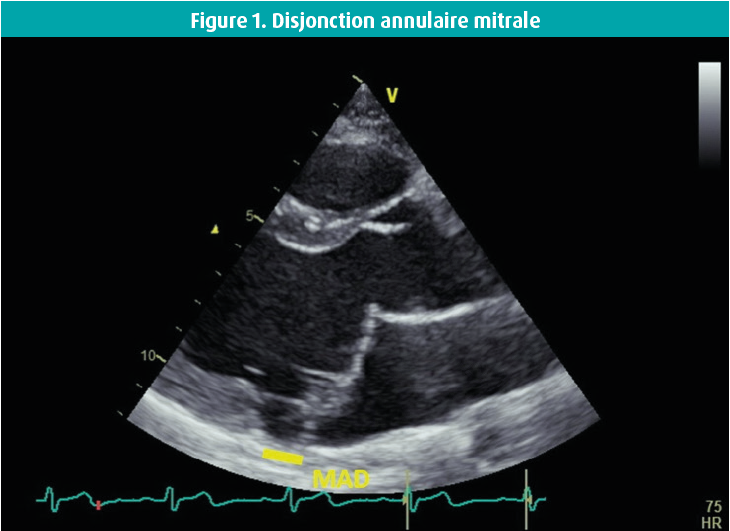
Après des années de silence, plusieurs études rétrospectives suggérant une association avec une AV complexe ont soudainement été publiées. Carmo et al. ont décrit la détection d'une DAM à l'échographie chez 55 % des patients présentant un PVM et ont distingué une corrélation linéaire entre le degré de disjonction et la survenue d'une AV.18 On a supposé que le degré de disjonction était lié à une ectopie ventriculaire et que > 8 mm était un pronostic défavorable parmi la population atteinte d'un PVMa.14, 18
La signification clinique était toutefois incertaine en l'absence d'études prospectives de grande taille. Jusqu'à présent, nous ne savons pas avec certitude si la DAM possède un lien de causalité avec une AV et si certains facteurs génétiques jouent un rôle.19 Par ailleurs, une DAM est aussi fréquemment découverte par hasard au scanner dans une population saine, sans PVM.21 La faible longueur moyenne de la disjonction dans cette étude montre que la DAM est une variable continue et que nous avons besoin d'une valeur limite pour distinguer une anatomie normale de la DAM pathologique. Faletra et al. se sont intéressés au surdiagnostic de la DAM : ils ont montré, par IRM, qu'une part importante des patients atteints d'un PVM et d'une DAM présentaient en fait une « pseudo-DAM », dans laquelle l'insertion anatomique était correcte, mais dont l'évaluation était erronée en systole en raison de la juxtaposition du feuillet postérieur protubérant et de la paroi atriale.20
Pronostic de la DAM, du PVM et du PVMa
Les plus nombreuses données prospectives sur la signification pronostique de la DAM ont été collectées à la Mayo Clinic, où 595 patients atteints d'un PVM ont été suivis pendant une décennie.23 Le diagnostic de DAM a été posé chez 30 % des patients et était typiquement associé au phénotype de PVMa avec redondance des feuillets et prolapsus des deux feuillets. La longueur moyenne de la DAM était de 7,5 mm. Bien que la DAM se soit avérée indépendamment associée à la survenue d'une AV, la mortalité à dix ans n'était pas influencée par rapport au PVM sans DAM.23, 24
Le risque annuel de mort subite d'origine cardiaque en présence d'un PVM est difficile à estimer mais se situe entre 0,2 et 0,4 %, la sévérité de l'IM étant le facteur le plus déterminant du pronostic.31 En outre, dans la sous-population de PVMa, le type d'AV est un prédicteur important, et jusqu'à présent le seul prédicteur indépendant, de la mortalité : il ressort de données de la cohorte de la Mayo Clinic que la mortalité à huit ans était de 10 % (± 2 %) chez les patients sans extrasystole, contre 17 % (± 3 %) dans le groupe atteint d'une AV. La mortalité était considérablement élevée dans le sous-groupe atteint d'une AV sévère définie comme une tachycardie ventriculaire documentée > 180/min.24 Des données prospectives relatives à un potentiel avantage de survie lors de l'implantation d'un ICD chez les patients présentant un PVMa font défaut.
Consensus actuel concernant la PVMa et son traitement
La dernière décennie a été caractérisée par des données contradictoires. Dans une tentative de clarification, une déclaration de consensus internationale a été publiée récemment par l'EHRA.25 La figure 2 présente l'algorithme de stratification du risque.
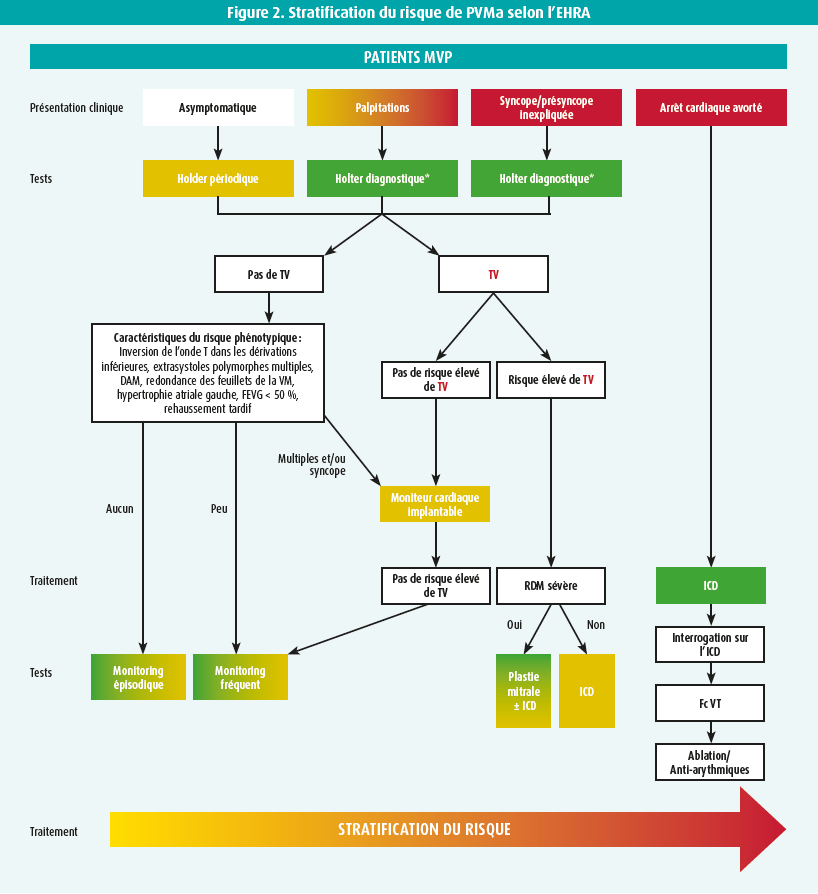
Le PVM arythmogène est défini comme un PVM avec AV fréquente (> 5 %) et/ou complexe, sans autre étiologie claire.25 Le phénotype morphologique n'est pas jugé nécessaire pour le diagnostic. Une anamnèse approfondie, un examen clinique, une échocardiographie et un holter de 24 heures sont recommandés chez tous les patients présentant un PVM, afin de détecter les facteurs de risque de PVMa. à l'électrocardiographie, le syndrome de PVMa se caractérise par des inversions de l'onde T dans les dérivations inférolatérales.26 L'ectopie ventriculaire est fréquemment présente et trouve principalement son origine dans les muscles papillaires ou l'anneau mitral.5, 12-14, 25, 27 à l'imagerie, il convient de rechercher, parallèlement à la quantification de l'IM, une DAM, un tissu valvulaire excessif, un prolapsus des deux feuillets et un rehaussement tardif à l'IRM.23, 25, 29
En ce qui concerne les déterminants d'un risque élevé d'AV (palpitations, syncopes, DAM, prolapsus des deux feuillets…), une surveillance prolongée du rythme à l'aide d'un holter de sept jours ou d'un moniteur cardiaque est recommandée.25 Une stratification du risque peut ainsi être établie, afin de détecter un risque élevé d'AV (TV > 180/min).
La prévention de la mort subite d'origine cardiaque au moyen d'un moniteur cardiaque implantable n'est recommandée qu'en cas d'antécédents documentés de mort subite d'origine cardiaque à la suite d'une FA ou d'une TV sans facteurs réversibles ou en cas de TV > 180/min symptomatique documentée. Par ailleurs, un moniteur cardiaque implantable peut être envisagé en cas de TV(NS) hémodynamiquement tolérée > 180 min/s si deux critères phénotypiques sont présents.25
Il n'existe pas de traitement spécifique du PVMa. Le traitement pharmacologique et/ou l'ablation de la TV doivent être envisagés chez tous les patients présentant une AV, indépendamment du phénotype et dans le contexte clinique correct. L'effet de la chirurgie valvulaire mitrale sur l'AV n'a pas encore été étudié, de sorte que les indications de la chirurgie sont identiques à celles de l'IM primaire sans phénotype arythmogène.
Conclusion
Le PVMa est un syndrome caractérisé par un PVM et une AV accompagnée d'un risque accru de mort subite d'origine cardiaque. Un patient montrant des caractéristiques de PVMa à l'ECG ou à l'imagerie requiert un monitoring intensif du rythme, mais l'implantation prophylactique d'un ICD n'est pas recommandée. La documentation d'une AV sévère définie comme une TV > 180 min est en revanche une indication d'implantation d'un ICD. La pathophysiologie du PVMa n'est pas encore totalement expliquée. Des études cliniques randomisées sont nécessaires pour affiner les algorithmes thérapeutiques.
Références
- Delling, F.N., Vasan, R.S. Epidemiology and pathophysiology of mitral valve prolapse: new insights into disease progression, genetics, and molecular basis. Circulation, 2014, 129 (21), 2158-2170.
- Freed, L.A., Levy, D., Levine, R.A., Larson, M.G., Evans, J.C., Fuller, D.L. et al. Prevalence and clinical outcome of mitral-valve prolapse. N Engl J Med, 1999, 341 (1), 1-7.
- Dziadzko, V., Dziadzko, M., Medina-Inojosa, J.R., Benfari, G., Michelena, H.I., Crestanello, J.A. et al. Causes and mechanisms of isolated mitral regurgitation in the community: clinical context and outcome. Eur Heart J, 2019, 40 (27), 2194-2202.
- Avierinos, J.F., Gersh, B.J., Melton, L.J.3rd, Bailey, K.R., Shub, C., Nishimura, R.A. et al. Natural history of asymptomatic mitral valve prolapse in the community. Circulation, 2002, 106 (11), 1355-1361.
- Basso, C., Perazzolo Marra, M., Rizzo, S., De Lazzari, M., Giorgi, B., Cipriani, A. et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation, 2015, 132 (7), 556-566.
- Adams, D.H., Rosenhek, R., Falk, V. Degenerative mitral valve regurgitation: best practice revolution. Eur Heart J, 2010, 31 (16), 1958-1966.
- Mahmood, S.S., Levy, D., Vasan, R.S., Wang, T.J. The Framingham Heart Study and the epidemiology of cardiovascular disease: a historical perspective. Lancet, 2014, 383 (9921), 999-1008.
- Hayek, E., Gring, C.N., Griffin, B.P. Mitral valve prolapse. Lancet, 2005, 365 (9458), 507-518.
- Enriquez-Sarano, M., Avierinos, J.F., Messika-Zeitoun, D., Detaint, D., Capps, M., Nkomo, V. et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med, 2005, 352 (9), 875-883.
- Enriquez-Sarano, M., Basmadjian, A.J., Rossi, A., Bailey, K.R., Seward, J.B., Tajik, A.J. Progression of mitral regurgitation: a prospective Doppler echocardiographic study. J Am Coll Cardiol, 1999, 34 (4), 1137-1144.
- Vahanian, A., Beyersdorf, F., Praz, F., Milojevic, M., Baldus, S., Bauersachs, J. et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2022, 43 (7), 561-632.
- Vohra, J., Sathe, S., Warren, R., Tatoulis, J., Hunt, D. Malignant ventricular arrhythmias in patients with mitral valve prolapse and mild mitral regurgitation. Pacing Clin Electrophysiol, 1993, 16 (3 Pt 1), 387-393.
- Sriram, C.S., Syed, F.F., Ferguson, M.E., Johnson, J.N., Enriquez-Sarano, M., Cetta, F. et al. Malignant bileaflet mitral valve prolapse syndrome in patients with otherwise idiopathic out-of-hospital cardiac arrest. J Am Coll Cardiol, 2013, 62 (3), 222-230.
- Perazzolo Marra, M., Basso, C., De Lazzari, M., Rizzo, S., Cipriani, A., Giorgi, B. et al. Morphofunctional Abnormalities of Mitral Annulus and Arrhythmic Mitral Valve Prolapse. Circ Cardiovasc Imaging, 2016, 9 (8), e005030.
- Muthukumar, L., Rahman, F., Jan, M.F., Shaikh, A., Kalvin, L., Dhala, A. et al. The Pickelhaube Sign: Novel Echocardiographic Risk Marker for Malignant Mitral Valve Prolapse Syndrome. JACC Cardiovasc Imaging, 2017, 10 (9), 1078-1080.
- Hutchins, G.M., Moore, G.W., Skoog, D.K. The association of floppy mitral valve with disjunction of the mitral annulus fibrosus. N Engl J Med, 1986, 314 (9), 535-540.
- Bharati, S., Granston, A.S., Liebson, P.R., Loeb, H.S., Rosen, K.M., Lev, M. The conduction system in mitral valve prolapse syndrome with sudden death. Am Heart J, 1981, 101 (5), 667-670.
- Carmo, P., Andrade, M.J., Aguiar, C., Rodrigues, R., Gouveia, R., Silva, J.A. Mitral annular disjunction in myxomatous mitral valve disease: a relevant abnormality recognizable by transthoracic echocardiography. Cardiovasc ultrasound, 2010, 8, 53.
- Bains, S., Tester, D.J., Asirvatham, S.J., Noseworthy, P.A., Ackerman, M.J., Giudicessi, J.R. A Novel Truncating Variant in FLNC-Encoded Filamin C May Serve as a Proarrhythmic Genetic Substrate for Arrhythmogenic Bileaflet Mitral Valve Prolapse Syndrome. Mayo Clin Proc, 2019, 94 (5), 906-913.
- Faletra, F.F., Leo, L.A., Paiocchi, V.L., Schlossbauer, S.A., Pavon, A.G., Ho, S.Y., Maisano, F. Morphology of Mitral Annular Disjunction in Mitral Valve Prolapse. J Am Soc Echocardiogr, 2022, 35 (2), 176-186.
- Toh, H., Mori, S., Izawa, Y., Fujita, H., Miwa, K., Suzuki, M. et al. Prevalence and extent of mitral annular disjunction in structurally normal hearts: comprehensive 3D analysis using cardiac computed tomography. Eur Heart J Cardiovasc Imaging, 2021, 22 (6), 614-622.
- Dejgaard, L.A., Skjolsvik, E.T., Lie, O.H., Ribe, M., Stokke, M.K., Hegbom, F. et al. The Mitral Annulus Disjunction Arrhythmic Syndrome. J Am Coll Cardiol, 2018, 72 (14), 1600-1609.
- Essayagh, B., Sabbag, A., Antoine, C., Benfari, G., Batista, R., Yang, L.T. et al. The Mitral Annular Disjunction of Mitral Valve Prolapse: Presentation and Outcome. JACC Cardiovasc Imaging, 2021, 14 (11), 2073-2087.
- Essayagh, B., Sabbag, A., Antoine, C., Benfari, G., Yang, L.T., Maalouf, J. et al. Presentation and Outcome of Arrhythmic Mitral Valve Prolapse. J Am Coll Cardiol, 2020, 76 (6), 637-649.
- Sabbag, A., Essayagh, B., Barrera, J.D.R., Basso, C., Berni, A., Cosyns, B. et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. Europace, 2022, 24 (12), 1981-2003.
- Nalliah, C.J., Mahajan, R., Elliott, A.D., Haqqani, H., Lau, D.H., Vohra, J.K. et al. Mitral valve prolapse and sudden cardiac death: a systematic review and meta-analysis. Heart, 2019, 105 (2), 144-151.
- Oliveri, F., Kakargias, F., Panday, P., Arcia Franchini, A.P., Iskander, B., Anwer, F., Hamid, P. Arrhythmic mitral valve prolapse: Diagnostic parameters for high-risk patients: A systematic review and meta-analysis. Pacing Clin Electrophysiol, 2021, 44 (10), 1746-1755.
- Lancellotti, P., Tribouilloy, C., Hagendorff, A., Popescu, B.A., Edvardsen, T., Pierard, L.A. et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging, 2013, 14 (7), 611-644.
- Essayagh, B., Sabbag, A., El-Am, E., Cavalcante, J.L., Michelena, H.I., Enriquez- Sarano, M. Arrhythmic mitral valve prolapse and mitral annular disjunction: pathophysiology, risk stratification, and management. Eur Heart J, 2023, 44 (33), 3121-3135.
- Han, H.C., Ha, F.J., Teh, A.W., Calafiore, P., Jones, E.F., Johns, J. et al. Mitral Valve Prolapse and Sudden Cardiac Death: A Systematic Review. J Am Heart Assoc, 2018, 7 (23), e010584.
- Muthukumar, L., Jahangir, A., Jan, M.F., Perez Moreno, A.C., Khandheria, B.K., Tajik, A.J. Association Between Malignant Mitral Valve Prolapse and Sudden Cardiac Death: A Review. JAMA Cardiol, 2020, 5 (9), 1053-1061.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.