L'insuffisance cardiaque (IC) est un trouble progressif qui touche environ 26 millions de personnes dans le monde.1-3 L'IC touche principalement les personnes âgées, avec plus de 80 % des hospitalisations pour IC survenant chez des personnes de plus de 65 ans. Dans près de la moitié des cas, la fraction d'éjection ventriculaire gauche est préservée (HFpEF).4
Selon les dernières recommandations de la Société Européenne de Cardiologie,3 il faut 4 conditions pour parler d'IC à fonction préservée:
- des symptômes ou des signes cliniques en faveur d'une insuffisance cardiaque;
- une fraction d'éjection ventriculaire gauche > 50 %;
- une élévation des taux de peptides natriurétiques (BNP > 35 pg/mL, ou NT-proBNP > 125 pg/mL);
- une anomalie de la fonction diastolique qui sera mise en évidence à l'écho-doppler et/ou une anomalie structurelle de type hypertrophie ventriculaire gauche ou dilatation auriculaire gauche.
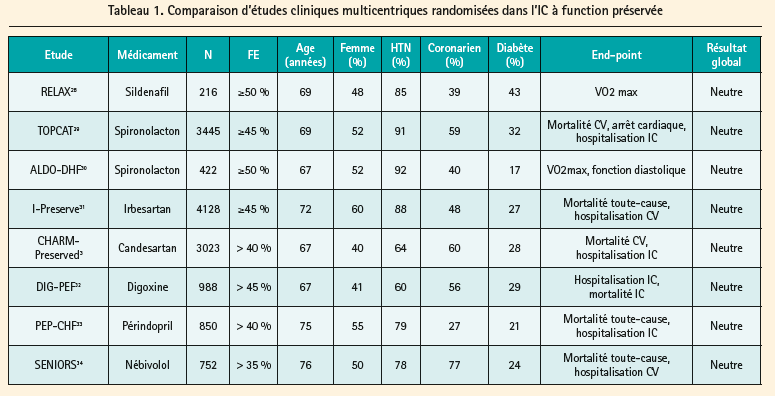
Contrairement à l'IC à fonction systolique réduite (HFrEF), il n'y a pas à l'heure actuelle de thérapies prouvées dans l'IC à fonction préservée. Les différentes molécules de l'insuffisance cardiaque à fonction systolique réduite ont en effet été testées sans succès (tableau 1). Mais une des grandes limitations de ces études cliniques est l'importante hétérogénéite dans les critères d'inclusion (fraction d'éjection variant de 35 % à > 50 %). Au vu de l'absence d'effet bénéfique de ces différentes molécules, la prise en charge de cette pathologie se concentre sur les symptômes du patient (secondaires essentiellement à la surcharge) ainsi qu'à une bonne prise en charge des comorbidités. La Société Européenne de Cardiologie3 énonce les recommandations suivantes:
- contrôle strict de l'hypertension;
- contrôle de la fréquence cardiaque, particulièrement en cas de fibrillation auriculaire;
- prévention secondaire de l'infarctus;
- contrôle strict des comorbidités;
- utilisation des diurétiques pour contrôler la rétention hydro-sodée.
L'IC à fonction préservée reste donc un syndrome pour lequel il n'y a pas à l'heure actuelle de thérapies prouvées.3, 4 CHARM-Preserved, une étude clinique prospective randomisée, a montré une mortalité et une morbidité importante: la mortalité cardiovasculaire dans le groupe traité médicalement était de 11,2 % après un suivi moyen de 3 ans, et la morbi- mortalité cardiovasculaire (décès, hospitalisation pour insuffisance cardiaque, infarctus du myocarde, accident vasculaire cérébral, revascularisation) était de 30,4 %.5 Ces chiffres mettent en évidence les limites des traitements actuels et justifient la poursuite des recherches pour mieux comprendre les différences entre la physiopathologie de ce syndrome et celui de l'IC à fonction ventriculaire gauche réduite.
L'IC symptomatique n'est que la surface de l'épidémie émergente. Le vieillissement de la population ainsi que la progression des facteurs de risque tels que l'hypertension, le diabète, l'obésité créent un nombre croissant de patients à risque particulièrement élevé pour le développement de l'IC. Le modèle de l'ACC-AHA (figure 1) souligne l'importance d'une identification précoce de ces patients asymptomatiques à risque, sans (stade A) ou avec (stade B) preuve de remodeling cardiaque, afin de faciliter l'action préventive et d'éviter la progression vers l'IC symptomatique (stade C)6 (figure 1).

Il existe en effet un continuum dans l'expression des altérations cardiaques structurelles et fonctionnelles qui surviennent avec l'âge: augmentation de l'épaisseur des parois ventriculaires gauches (VG) et de la masse VG, modifications dans le modèle de remplissage diastolique et du rythme cardiaque.7-9 La dysfonction endothéliale et la rigidité artérielle augmentent également avec l'âge, résultant en une augmentation globale de la charge artérielle sur le ventricule gauche.7 L'augmentation de la taille de l'oreillette gauche, véritable baromètre de la pression diastolique dans le VG, est également observée.7-9
Tous ces changements liés à l'âge dans la structure et la fonction cardiovasculaire peuvent passer inaperçus pendant de nombreuses années, mais avec l'apparition d'un stress aigu comme l'ischémie myocardique ou la fibrillation auriculaire, ces dysfonctionnements subcliniques peuvent entraîner de l'IC.7 Les différents facteurs de risque cliniques pour l'IC, y compris l'hypertension, l'obésité, le diabète et la dysfonction rénale, sont associés avec des perturbations similaires.10-12 Ces comorbidités semblent accélérer ou potentialiser les processus déjà en jeu au cours du processus de vieillissement.7 Toutes ces différents comorbidités entraînent un état pro-inflammatoire avec une élévation des taux d'interleukin-6 (IL-6), de TNF-α, de ST-2 et de la pentraxin 3. Il y a lors une activation endothéliale coronaire microvasculaire avec productions de radicaux libres (ROS), une activation des facteurs d'adhésion (VCAM et E-selectin), une dysfonction du signal NO, GMPc et de l'activité de la protéine kinase G (endothélial-cardiomyocyte), et enfin à une infiltration par les cellules inflammatoires avec production de cytokines profibrotiques. L'hypertrophie des cardiomyocytes et la fibrose interstitielle qui en résultent provoquent alors une relaxation incomplète et une raideur augmentée des cardiomyocytes (figure 2).13, 14
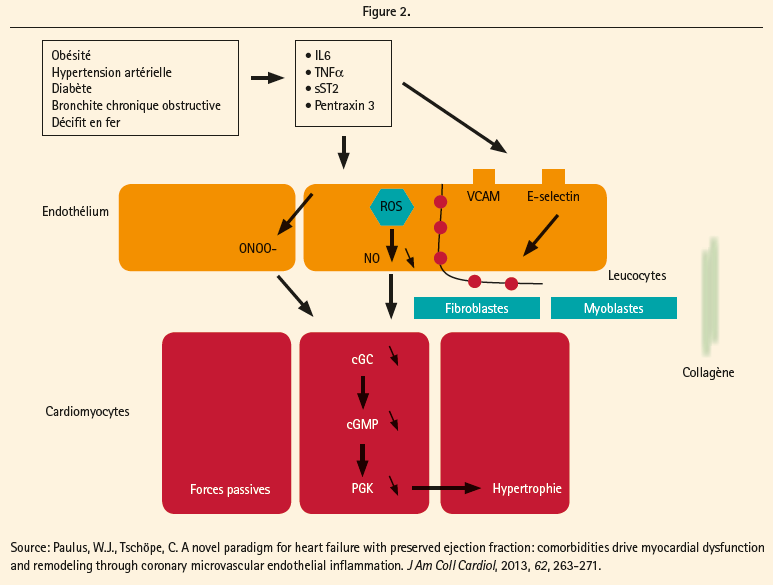
Au niveau anatomopathologique,15 une étude récente a démontré d'autres modifications structurelles chez les patients souffrant d'HFPEF par rapport à une population du même âge: hypertrophie cardiaque plus importante, maladie coronarienne épicardique plus importante, raréfaction microvasculaire coronaire (associée à une dysfonction endothéliale microvasulaire) et fibrose myocardique plus importante. Des signes d'inflammation systémique et myocardique ont également été démontré dans cette population.12 L'inflammation endothéliale microvasculaire pourrait être le facteur déclenchant de la raréfaction microvasulaire, de la fibrose myocardique observée et d'autres perturbations menant à l'IC à fonction préservée.
Cependant, les facteurs responsables de la transition du stade B au stade C de l'IC chez les personnes âgées ont été difficiles à caractériser. Les mécanismes potentiels responsables de la transition vers l'IC manifeste comprennent: altération progressive de la performance systolique du VG et perte de la synchronie, altération de la fonction contractile de l'oreillette gauche, apparition d'une hypertension artérielle pulmonaire et une augmentation de la résistance vasculaire pulmonaire et les comorbidités (insuffisance rénale, l'obésité et anémie) associé à une rétention hydrique (figure 3).16
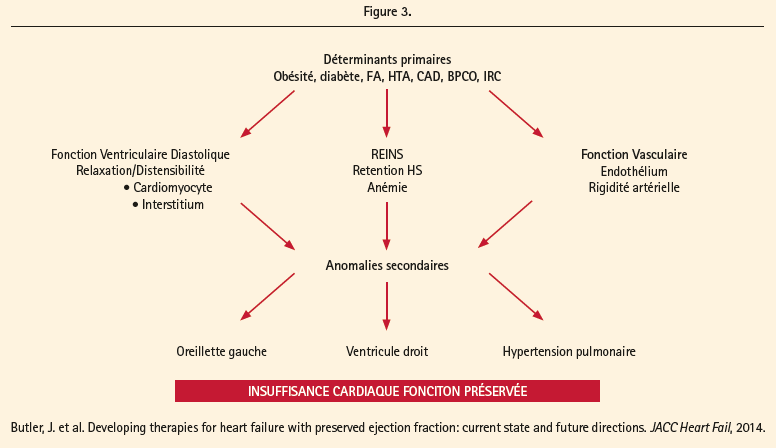
En conséquence, des études échocardiographiques de la structure et de la fonction ventriculaire gauche (VG) et droite et (VD) sont indispensables à réaliser.
L'échocardiographie souligne habituellement, en plus d'une fraction d'éjection du VG préservée, un remodelage du VG, des pressions de remplissage élevées du VG et de diverses anomalies de la fonction diastolique.17, 18 Plus récemment, certaines études ont démontré également une dysfonction systolique longitudinale du VG.19-21 Comme les myocytes sous-endocardiques sont les plus vulnérables aux effets de l'ischémie ou du stress hémodynamique, les déficiences dans la déformation longitudinale semblent précéder les déficiences dans la déformation circonférentielle.19 Le vieillissement progressif et les facteurs de risque habituels ont été associés à des déficiences dans les deux mesures.20, 21 La contraction ventriculaire dyssynchrone aggrave la dysfonction du myocarde et est associée à une mauvaise évolution chez les patients atteints de dysfonction systolique du VG. Il a été démontré que l'asynchronisme du VG fournit des informations prédictives chez les patients à haut risque après un infarctus du myocarde.22 Enfin, la contraction et la relaxation ventriculaires dyssynchrones ont également été identifiées chez les personnes présentant des facteurs de risque de HF comme le vieillissement, l'hypertension, le diabète et hypertrophie du ventricule gauche avec une FEVG préservée. Plusieurs études échocardiographiques ont montré une prévalence élevée (près de 60 %) de l'asynchronisme systolique et / ou diastolique de sujets ayant une IC à fonction préservée.23
Le VD est également impliqué dans l'IC à fonction préservée et il ne faut pas l'ignorer. De récents articles décrivent une atteinte de la fonction VD chez près de 30 % des patients atteints d'IC à fonction préservée. En effet, l'élévation chronique des pressions de remplissage du VG mène à un remodelage de l'oreillette gauche avec dysfonction, à une hypertension artérielle pulmonaire puis finalement à un remodelage et une dysfonction du ventricule droit. L'atteinte de la fonction du VD est donc importante à reconnaitre, ces anomalies étant régulièrement associées à des atteintes cliniques et échographiques plus sévères et à un plus mauvais pronostique.24, 25
Le bilan par imagerie peut également être complété par la réalisation d'une résonance magnétique nucléaire. En effet, des études par résonance magnétique nucléaire de la structure et fonction du VG sont de plus en plus utilisées en vue de mieux pouvoir caractériser la structure du myocarde. La fibrose interstitielle globale peut être quantifiée avec une séquence de cartographie de T1 (MOLLI). Ce nouveau type d'imagerie permet d'identifier la présence de fibrose myocardique. En effet, une étude récente a objectivé une corrélation dans l'IC à fonction préservée (et non dans l'IC à fonction réduite) entre la majoration de la fibrose myocardique diffuse et la détérioration de la fonction diastolique, démontrant ainsi le rôle certain de la fibrose dans la pathogenèse de l'IC à fonction préservée.26, 27
Toutefois, comme le débit cardiaque est conservé au repos, ces seules anomalies n'expliquent pas la gravité de la rétention d'eau par le rein, les épisodes d'oedème aigu du poumon et de la progression de la maladie. Il est bien établi que la rétention hydro-sodée par le rein contribue significativement à la morbidité de ce syndrome. En outre, l'activation du système rénine-angiotensine-aldostérone crée un cercle vicieux, la promotion de l'hypertrophie et la fibrose myocardique, et aggrave les anomalies de la fonction diastolique. Plusieurs mécanismes hormonaux compensatoires, notamment la sécrétion d'ANP et le BNP par les cavités cardiaques, sont activés dans ce syndrome, mais semblent insuffisants pour normaliser l'excrétion de sodium (rôle down-régulation des récepteurs? rôle de l'endothéline et l'aldostérone?).
En conclusion, la physiopathologie de l'IC à fonction préservée reste complexe et encore incomplètement comprise. Il est donc nécessaire de réaliser des études en vue de mieux caractériser et catégoriser le phénotype cardiaque, améliorant ainsi les cibles possibles pour des traitements expérimentaux.
L'objectif de notre recherche est de définir certains des mécanismes qui soustendent la progression et les complications de l'insuffisance cardiaque (IC) avec une fraction d'éjection ventriculaire gauche préservée et de déterminer les facteurs pronostiques, en utilisant de nouvelles techniques d'échocardiographie et d'imagerie par résonance magnétique. Notre étude comprendra des sujets sains, âgés de 25 à 75 ans (contrôle), les patients asymptomatiques avec un ou plusieurs facteurs de risque d'athérosclérose sans (stade A) ou avec la preuve de remodelage cardiaque (stade B) et les patients symptomatiques (stade C) avec IC à fonction préservée. Tous ces patients seront caractérisés par échocardiographie et IRM, et suivis au fil du temps.
Objectif 1: Évaluer les différences dans la structure cardiaque, la fonction et les marqueurs de fibrose à travers le spectre de phases IC afin d'approfondir notre compréhension de la physiopathologie de conduire la progression de la IC.
Objectif 2: Définir les mécanismes par lesquels les facteurs de risque de l'IC, comme l'hypertension, le diabète, l'obésité et l'insuffisance rénale, interagissent avec l'âge pour augmenter le risque de l'IC, et d'évaluer le rôle des facteurs déclenchants tels que l'ischémie myocardique, la fibrillation auriculaire dans HFPEF.
Objectif 3: Déterminer les facteurs pronostiques chez les patients HFPEF, en suivant ces patients au fil du temps. En conséquence, nous allons essayer d'établir une corrélation entre les données de référence (échocardiographie, IRM ou biomarqueurs) et les événements cardiovasculaires. Nous essaierons de déterminer si ces mesures fournissent des renseignements supplémentaires au-delà des caractéristiques cliniques.
Références
- McMurray, J.J., Petrie, M.C., Murdoch, D.R., Davie, A.P. Clinical epidemiology of heart failure: public and private health burden. Eur Heart J, 1998, 19, Suppl P, 9.
- Heart Disease and Stroke Statistics—2017 Update. A Report From the American Heart Association. Circulation, 2017, 135, 00-00.
- Voors, A. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2016, 37, 2129-2200.
- Redfield, M.M., Jacobsen, S.J., Burnett, J.C. Jr., Mahoney, D.W., Bailey, K.R., Rodeheffer, R.J. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA, 2003, 289, 194-202.
- Yusuf, S., Pfeffer, M.A., Swedberg, K. et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet, 2003, 362, 777-781.
- Jessup, M., Abraham, W.T., Casey, D.E., Feldman, A.M. et al. 2009 focused update: ACCF/AHA Guidelines for the Diagnosis and Management of Heart Failure in Adults. Circulation, 2009, 119, 1977-2016.
- Lakatta, E.G. Arterial and cardiac aging: major shareholders in cardiovascular disease. Part I: aging arteries: a “set up” for vascular disease. Circulation, 2003, 28, 107, 139-146.
- Lakatta, E.G., Levy, D. Arterial and cardiac aging: major shareholders in cardiovascular disease. Part II: the aging heart in health: links to heart disease. Circulation, 2003,107, 346-354.
- Solomon, S.D., Janardhanan, R., Verma, A. et al; Valsartan In Diastolic Dysfunction (VALIDD) Investigators. Effect of angiotensin receptor blockade and antihypertensive drugs on diastolic function in patients with hypertension and diastolic dysfunction: a randomised trial. Lancet, 2007, 369, 2079-2087.
- Powell, B.D., Redfield, M.M., Bybee, K.A., Freeman, W.K., Rihal, C.S. Association of obesity with left ventricular remodeling and diastolic dysfunction in patients without coronary artery disease. Am J Cardiol, 2006, 98, 116-120.
- Devereux, R.B., Roman, M.J., Paranicas, M., O'Grady, M.J. et al. Impact of diabetes on cardiac structure and function: the strong heart study. Circulation, 2000, 101, 2271-2276.
- Hayashi, S.Y., Rohani, M., Lindholm, B., Brodin, L.A., Lind, B. et al. Left ventricular function in patients with chronic kidney disease evaluated by colour tissue Doppler velocity imaging. Nephrol Dial Transplant, 2006, 21, 125-132.
- Paulus, W.J., Tschöpe, C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol, 2013, 62, 263-271.
- Burke, M.A., Katz, D.H., Beussink, L., Selvaraj, S., Gupta, D.K., Fox, J., et al. Prognostic importance of pathophysiologic markers in patients with heart failure and preserved ejection fraction. Circ Heart Fail, 2014, 7, 288-299.
- Mohammed, S.F., Hussain, S.,. Mirzoyev, S.A.; Edwards, W.D., Maleszewski, J.J., Redfield, M.M. Coronary Microvascular Rarefaction and Myocardial Fibrosis in Heart Failure With Preserved Ejection Fraction. Circulation, 2015, 131, 550-559.
- Butler, J., Fonarow, G.C., Zile, M.R., Lam, C.S., Roessig, L., Schelbert, E.B. et al. Developing therapies for heart failure with preserved ejection fraction: current state and future directions. JACC Heart Fail, 2014, 2 (2), 97-112.
- Lam, C.S., Roger, V.L., Rodeheffer, R.J., Bursi, F., Borlaug, B.A., Ommen, S.R., Kass, D.A., Redfield, M.M. Cardiac structure and ventricular-vascular function in persons with heart failure and preserved ejection fraction from Olmsted County, Minnesota. Circulation, 2007, 115, 1982-1990.
- Sohn, D.W., Chai, I.H., Lee, D.J., Kim, H.C., Kim, H.S. et al. Assessment of mitral annulus velocity by Doppler tissue imaging in the evaluation of left ventricular diastolic function. J Am Coll Cardiol, 1997, 30, 474- 480.
- Sengupta, P.P., Tajik, A.J., Chandrasekaran, K., Khandheria, B.K. Twist mechanics of the left ventricle: principles and application. JACC Cardiovasc Imaging, 2008, 1, 366-376.
- Kang, S.J., Lim, H.S., Choi, B.J., Choi, S.Y., Hwang, G.S., Yoon, M.H., Tahk, S.J., Shin, J.H. Longitudinal strain and torsion assessed by two-dimensional speckle tracking correlate with the serum level of tissue inhibitor of matrix metalloproteinase-1, a marker of myocardial fibrosis, in patients with hypertension. J Am Soc Echocardiogr, 2008, 21, 907-911.
- Ng, A.C., Delgado, V., Bertini, M., van der Meer, R.W., Rijzewijk, L.J. et al. Findings from left ventricular strain and strain rate imaging in asymptomatic patients with type 2 diabetes mellitus. Am J Cardiol, 2009, 104, 1398-1401.
- Shin, S.H., Hung, C.L., Uno, H. et al. Valsartan in Acute Myocardial Infarction Trial (VALIANT) Investigators. Mechanical dyssynchrony after myocardial infarction in patients with left ventricular dysfunction, heart failure, or both. Circulation, 2010, 121, 1096-1103.
- Yu, C.M., Zhang, Q., Yip, G.W.K., Lee, P.W., Kum, L.C.C., Lam, Y.Y., Fung, J.W.H. Diastolic and systolic asynchrony in patients with diastolic heart failure: a common but ignored condition. J Am Coll Cardiol, 2007, 49, 97-105.
- Mohammed, S.F., Hussain, I., Abou Ezzeddine, O.F., Takahama, H., Kwon, S.H., Forfia, P. et al. Right Ventricular Function in Heart Failure with Preserved Ejection Fraction: A Community Based Study. Circulation, 2014, 130 (25), 2310-2320.
- Guazzi, M., Dixon, D., Labate, V., Beussink-Nelson, L., Bandera, F., Cuttica, M.J. et al. Right Ventricular Contractile Function and its Coupling to Pulmonary Circulation in Heart Failure With Preserved Ejection Fraction Stratification of Clinical Phenotypes and Outcomes. JACC: Cardiovascular Imaging. April 2017. In press.
- Su, M.Y., Lin, L.Y., Tseng, Y.H., Chang, C.C., Wu, C.K., Lin, J.L., Tseng, W.Y. CMR-verified diffuse myocardial fibrosis is associated with diastolic dysfunction in HFpEF. JACC Cardiovasc Imaging. 2014, 7 (10), 991- 997.
- Duca, F., Kammerlander, A.A., Zotter-Tufaro, C., Aschauer, S., Schwaiger, M.L., Marzluf, B.A. et al. Interstitial Fibrosis, Functional Status, and Outcomes in Heart Failure With Preserved Ejection Fraction: Insights From a Prospective Cardiac Magnetic Resonance Imaging Study. Circ Cardiovasc Imaging, 2016, 9 (12), pii: e005277.
- Redfield, M.M., Chen, H.H., Borlaug, B.A., Semigran, M.J., Lee, K.L., Lewis, G. et al. Effect of phosphodiesterase- 5 inhibition on exercise capacity and clinical status in heart failure with preserved ejection fraction: a randomized clinical trial, RELAX Trial. JAMA, 2013, 309 (12), 1268-1277.
- Pitt, B., Pfeffer, M.A., Assmann, S.F., Boineau, R., Anand, I.S., Claggett, B. et al. TOPCAT Investigators- Spironolactone for heart failure with preserved ejection fraction. N Engl J Med, 2014, 370 (15), 1383- 1392.
- Edelmann, F., Wachter, R., Schmidt, A.G., Kraigher- Krainer, E., Colantonio, C., Kamke, W. et al. Aldo-DHF InvestigatorsEffect of spironolactone on diastolic function and exercise capacity in patients with heart failure with preserved ejection fraction: the Aldo- DHF randomized controlled trial. JAMA, 2013, 309 (8), 781-791.
- Massie, B.M., Carson, P.E., McMurray, J.J., Komajda, M., McKelvie, R., Zile, M.R., Anderson, S., Donovan, M., Iverson, E., Staiger, C., Ptaszynska, A.; I-PRESERVE Investigators.Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med, 2008, 359 (23), 2456-2467.
- Ahmed, A., Rich, M.W., Fleg, J.L., Zile, M.R., Young, J.B., Kitzman, D.W., et al. Effects of digoxin on morbidity and mortality in diastolic heart failure: the ancillary digitalis investigation group trial. Circulation, 2006, 114 (5), 397-403.
- Cleland, J.G., Tendera, M., Adamus, J., Freemantle, N., Polonski, L., Taylor, J. PEP-CHF Investigators. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J, 2006, 27 (19), 2338-2345.
- Flather, M.D., Shibata, M.C., Coats, A.J., Van Veldhuisen, D.J., Parkhomenko, A., Borbola, J., Cohen-Solal, A. et al. SENIORS Investigators.Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J, 2005, 26 (3), 215-225.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.