L'insuffisance cardiaque à fonction systolique altérée est une pathologie fréquente dont le traitement est bien connu des cliniciens. Cependant, la place de l'anticoagulation dans l'insuffisance cardiaque reste un sujet à controverse. Nous décrivons le cas d'une patiente qui a présenté une ischémie aiguë des membres inférieurs d'origine embolique à point de départ ventriculaire gauche. L'objectif de la publication est de discuter de l'anticoagulation des insuffisances cardiaques à fonction systolique altérée. Les données actuelles de la littérature, dont les recommandations européennes, sont peu nombreuses concernant l'introduction d'un traitement anticoagulant chez ces patients.
Introduction
Nous présentons un cas clinique d'une complication rare, mais grave d'embole cardiaque, chez une patiente présentant une cardiomyopathie non ischémique dilatée avec fraction d'éjection du ventricule gauche (FEVG) effondrée, d'origine indéterminée (probablement post-virale). La prise en charge chirurgicale (Fogarty) de la patiente a permis une amélioration rapide des symptômes et l'évitement de complications irréversibles.
Après description de la clinique et de la prise en charge de la patiente, nous discuterons des indications d'un traitement anticoagulant systématique chez les patients souffrant de FEVG basse. Les recommandations européennes sur les infarctus STEMI et les cardiomyopathies ne donnent que peu d'informations à ce sujet.1, 2
Observation clinique
Une patiente, âgée de 44 ans se présente au service des soins d'urgence pour fatigue, dyspnée de grade NYHA III et palpitations apparues quelques semaines plus tôt. Ses antécédents sont dominés par un tabagisme actif (60 UAP), une hypercholestérolémie, un accident ischémique transitoire (AIT), et des fausses couches à répétition (4 ×). Son traitement journalier comprend de l'aspirine (Asaflow®) 80 mg 1 ×, de l'atorvastatine (Lipitor®) 20 mg 1 ×, du sotalol (Sotalex®) 160 mg 1 × débuté récemment, et du désogestrel-éthinylestradiol (Marvelon®). Les examens complémentaires réalisés aux urgences ont mis en évidence:
- un état général conservé avec un BMI normal (153 cm pour 48 kg);
- des signes cliniques de décompensation cardiaque, avec une TA à 100/60 mmHg, une tachycardie régulière à 120 bpm, un souffle d'insuffisance mitrale, quelques crépitants aux bases et de légers oedèmes des membres inférieurs;
- une biologie avec BNP à 1081 pg/ml (N < 100); une troponine à 13 pg/ ml (N < 14), une créatinine à 0,7 mg/ dl (N < 1,2), une CRP normale, des D-Dimères à 960 ng/ml (N < 500) et des tests hépatiques normaux;
- à l'ECG à 12 dérivations, une tachycardie sinusale à 122 bpm, sans séquelle d'infarctus, et troubles de repolarisation;
- une échographie cardiaque montrant une dilatation du VG avec hypokinésie globale et FEVG estimée à 25 %, insuffisance mitrale modérée; il n'y pas de signes d'HTA pulmonaire;
- un scanner pulmonaire réalisé dans le service des urgences permettant d'exclure une embolie pulmonaire; on note, par ailleurs, un épanchement pleural droit et une cardiomégalie importante.
L'urgentiste prescrit du Lasix® (furosémide) à raison de deux ampoules IV (40 mg) et la patiente est hospitalisée dans le service de cardiologie, avec monitoring continu pour bilan. Le traitement est complété par un inhibiteur de l'enzyme de conversion (IEC) et un bêtabloquant. Dans le bilan, une cardiopathie ischémique est exclue par un scanner coronaire strictement normal; l'absence d'anomalies à l'ECG à 12 dérivations et de zones akinétiques à l'échographie permettait déjà cette hypothèse.
Juste après l'examen, la patiente se plaint de fortes douleurs dans les deux membres inférieurs. Ses deux jambes sont blanches, froides et aucun pouls n'est plus perçu. La clinique confirme une ischémie aiguë des membres inférieurs ('les 5 P'): pain (douleur intense de début brutal localisée au groupe de muscle en aval de l'occlusion), paresthésies, paralysie, pâleur (membre pâle et froid) et absence de pouls distaux.
On évoque, en première hypothèse, une thrombose aiguë bilatérale sur produit de contraste. Une cause embolique semble peu probable vu l'échocardiographie récente sans thrombus apical et l'absence d'accès de fibrillation auriculaire. Un tabagisme actif et la prise de contraceptif hormonal combinés chez notre patiente sont une association thrombogène connue.
En urgence, une échographie Doppler des membres inférieurs est réalisée et confirme l'occlusion des deux artères fémorales. Un second scanner est réalisé rapidement confirmant un caillot dans l'artère fémorale primitive droite avec un arrêt complet du flux au niveau de l'artère poplitée droite, ainsi qu'une absence de flux sanguin dans l'artère iliaque primitive gauche.
Le radiologue nous revient avec une image très récente (< 1h00) avec un énorme thrombus intraventriculaire gauche (14 × 22 × 22 mm), visible sur le premier angioscanner cardiaque (figure 1); celui-ci n'est plus retrouvé dans le second examen radiologique … Le diagnostic d'accident embolique, dans le cadre de cette cardiomyopathie non ischémique d'origine indéterminée (probablement post-virale) est alors évident.
L'évolution a été favorable après embolectomie chirurgicale (Fogarty). Un traitement anticoagulant a été rapidement prescrit par la suite: HBPM à dose thérapeutique suivi d'un traitement par antivitamines K (acénocoumarol-sintrom®) pour un INR à 2-3. La durée du traitement sera fonction de l'évolution de la cardiomyopathie sous traitement optimal (bêtabloquant, IEC et spironolacton).
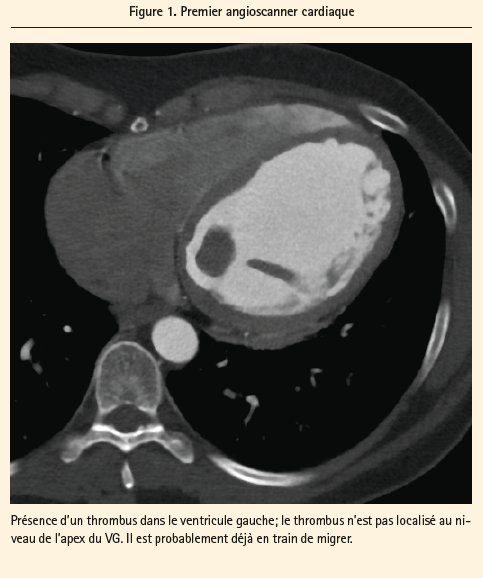
Discussion
La formation d'un thrombus ventriculaire gauche est une complication connue des infarctus du myocarde, principalement avec sus-élévation des segments ST (STEMI) antérieurs.1 C'est la raison pour laquelle une reperfusion rapide est désirable et qu'une anticoagulation curative est préconisée souvent en post-infarctus. De nombreux AVC et embolies ont également été observés chez les patients souffrant de décompensation cardiaque, quelle que soit son étiologie, principalement lorsque la FEVG est réduite.1, 3, 4
La stase du sang dans le coeur, quelle que soit son étiologie, augmente le risque de formation d'un thrombus. Une large zone akinétique du ventricule gauche, surtout au niveau de l'apex, peut être la cause de formation du caillot (figures 2 et 3).
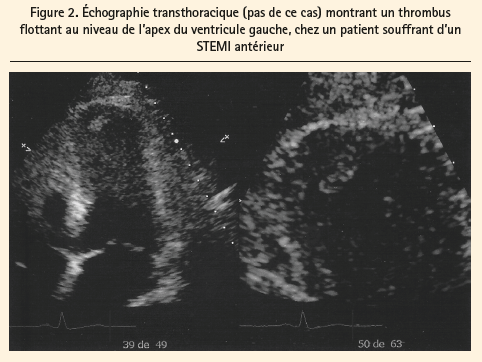
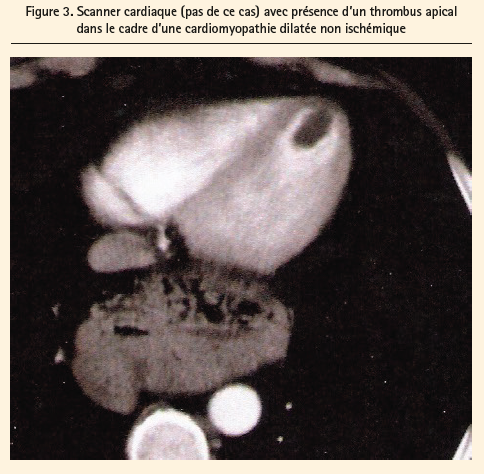
Les trois principaux facteurs de risque de formation de thrombi (endéans les 15 jours d'un STEMI) dans le ventricule gauche sont les suivants:
- STEMI de localisation antérieure;
- occlusion de l'artère interventriculaire antérieure;
- STEMI étendu avec FEVG < 30 % et anévrisme ventriculaire associé.
Les cardiomyopathies non ischémiques avec dysfonction ventriculaire sont également à risque d'accident embolique.4 Les causes les plus fréquentes sont les myocardites (virales), les toxiques (alcool), les médications anticancéreuses (anthracycline), des maladies infiltratives (amyloïdose), des déficiences nutritionnelles (béribéri), ou la FA rapide (tachycardia- induced). Des étiologies plus rares ont été publiées dans la littérature: cardiomyopathie du postpartum, syndrome de Tako-Tsubo, non compaction du VG.5-7
L'incidence de la thrombose intraventriculaire gauche varie selon les séries: de 5 % à 25 % après infarctus du myocarde et de 11 % à 36 % en cas de myocardiopathie dilatée.3, 4
Concernant les sujets souffrant de décompensation cardiaque avec diminution de la FEVG, la pathogenèse des thrombo-embolies peut être expliquée par la triade de Virchow:
- flux sanguin anormal, dû à la dilatation des cavités cardiaques et la mauvaise contraction des ventricules;
- état d'hypercoagulabilité. Les patients souffrant de décompensation cardiaque avec fraction d'éjection diminuée, en rythme sinusal, ont souvent une augmentation de l'activation plaquettaire et de la viscosité du plasma;
- dysfonction endothéliale.
L'échocardiographie peut objectiver des états préthrombotiques, avec la présence d'échos de contraste spontanés (ou de volutes de fumée (smoke-like echoes des Anglo-Saxons), dû au ralentissement circulatoire et à la formation d'agrégats de cellules sanguines favorisés par la stase. À noter que dans le cadre d'une fibrillation auriculaire (FA) non valvulaire, un caillot peut se former au niveau de l'auricule gauche, par stase lié à l'absence de contraction active de l'auricule, et être à l'origine d'embole cérébral (AVC) ou périphérique. Le mécanisme physiopathologique est donc différent, vu l'absence d'atteinte de l'endocarde ou de dysfonction endothéliale.
L'échographie transthoracique est considérée comme l'examen 'gold standard' dans l'évaluation de la fonction cardiaque et la recherche de thrombus, qui apparaissent comme des défects, séparés du myocarde par le contraste. L'examen peut se faire rapidement, mais est dépendant de l'opérateur. Sa sensibilité (23 %) est considérée très faible.8
Si l'échographie ne visualise pas de manière optimale la paroi endocardique, surtout apicale, une échographie de contraste doit être réalisée pour exclure un thrombus, avant toute autre investigation.
En cas de doute ou de mauvaise échogénéicité, une imagerie par résonance magnétique (IRM) cardiaque avec injection de gadolinium doit être envisagée, malgré son coût élevé et sa mauvaise disponibilité. Plusieurs études, dont celle de Srichai, confirment que l'IRM semble avoir une meilleure spécificité et sensibilité (99 % et 88 %) que l'échographie transthoracique (96 % et 23 %) ou transoesophagienne (96 % et 40 %) pour la détection de thrombus cardiaque.8 L'échographie transoesophagienne n'est pas recommandée d'emblée vu sa mauvaise visualisation de l'apex du VG. Le scanner injecté, avec une phase précoce et une phase tardive, pourrait également être une alternative à la recherche d'un thrombus dans une cavité cardiaque. Notre équipe a clairement démontré l'intérêt de l'utilisation du scanner dans la recherche d'un thrombus dans l'auricule gauche avant cardioversion pour FA.9 Il faudra s'assurer que le patient ne soit pas allergique aux produits de contraste et qu'il ait une fonction rénale correcte.
En cas de thrombus intraventriculaire, le risque d'embolisation chez les patients non anticoagulés est de 10 à 15 % et la plupart du temps, les embolisations se déroulent endéans les quatre premiers mois. Il existe deux facteurs de risque échographiques d'embolisation: la mobilité et la protrusion du thrombus. En cas de thrombus détecté, il est impératif de suivre l'évolution de la taille du caillot par échographie transthoracique ou IRM cardiaque. On notera alors une diminution de la taille du thrombus ou sa réorganisation sous anticoagulants, le risque d'embolisation diminuant alors nettement.
Il est recommandé de débuter rapidement un traitement anticoagulant chez les patients ayant souffert de STEMI antérieur étendu pour éviter la formation de thrombus intraventriculaire. Cependant, aucun consensus n'a été établi jusqu'à présent concernant l'instauration ou non d'un traitement anticoagulant chez les autres patients à haut risque de formation de thrombus, telles que les personnes ayant une FEVG inférieure à 30 % et/ou une akinésie apicale étendue, comme la patiente discutée dans ce case report.1, 3
Alors que le risque thromboembolique chez les sujets en FA est validé par le score CHA2DS2-VASc, aucun score similaire n'est disponible pour les patients souffrant de décompensation cardiaque en rythme sinusal. Une étude, menée en 2015, a essayé d'établir des facteurs de risque d'AVC et d'embolies chez ces derniers, tels que l'âge, le score NYHA, les antécédents d'AVC, le diabète et le BMI, mais aucune conclusion n'a été validée jusqu'à présent.10 Il serait intéressant de mener plus loin les recherches à ce sujet. Il est toujours crucial, dans la décision de mise en route d'un traitement, de peser les bénéfices et les risques. L'hémorragie dans ce cas bien précis est la principale préoccupation, d'autant plus que ces patients avec infarctus du myocarde reçoivent déjà un double traitement antiplaquettaire (aspirine + clopidogrel, ticagrelor (brilique®) ou prasugrel (efient®) pendant un an minimum.
Les antiplaquettaires ne préviennent malheureusement que très peu de la formation des thrombi intraventriculaires et ne peuvent donc remplacer une anticoagulation conventionnelle avec les antivitamines K (AVK). De plus, aucune donnée n'a été publiée quant à l'utilisation des NOAC dans la prévention de la formation de caillots intracardiaques.
Enfin, une méta-analyse a comparé les effets des traitements anticoagulants de type AVK (warfarine) aux antiplaquettaires (aspirine) chez les sujets en décompensation cardiaque en rythme sinusal et n'a pas montré de diminution de la mortalité ou des effets thromboemboliques dans un des deux groupes.11 Le groupe 'warfarine' a souffert de moins d'AVC et d'embolies, mais un nombre plus important de patients de ce groupe a présenté des saignements majeurs. D'où l'absence de recommandation de traitement systématique par anticoagulation.
Conclusion
Chez les patients à haut risque de développement de thrombi intraventriculaires, il est recommandé de peser la balance bénéfices/risques d'une anticoagulation à court ou à moyen terme. Certains auteurs recommandent une anticoagulation d'emblée dans les cas de STEMI antérieur étendu ou de cardiomyopathie non ischémique avec altération sévère de la FEVG. La présence d'un thrombus, le plus souvent apical, semble, par contre, une indication formelle d'anticoagulation par AVK à long-terme. En l'absence d'infarctus du myocarde étendu ou de dysfonction ventriculaire gauche, un bilan d'hypercoagulabilité est souhaité si un thrombus est détecté (cf. triade de Virchow).
Références
- Steg, P.G., James, S.K., Atar, D. et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J, 2012, 33, 2569-2619.
- Ponikowski, P., Voors, A.A., Anker, S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2016, 37, 2129- 2200.
- Delewi, R., Zijlstra, F., Piek, J.J. Left ventricular thrombus formation after acute myocardial infarction. Heart, 2012, 98, 1743-1749.
- Gottdiener, J.S., Gay, J.A., Vanvoorhees, L., DiBianco, R., Fletcher, R. Frequency and embolic potential of left ventricular thrombus in dilated cardiomyopathy: Assessment by two-dimensional echocardiography. Am J Cardiol, 1983, 52, 1281-1285.
- Napporn, A.G., Kane, A., Damorou, J.M. et al. Intraventricular thrombosis complicating peripartum idiopathic myocardiopathy. Ann Cardiol Angeiol, 2000, 49, 309-314.
- de Gregorio, C., Grimaldi, P., Lentini, C. Left ventricular thrombus formation and cardioembolic complications in patients with Tako-Tsubo-like syndrome: a systematic review. Int J Cardiol, 2008, 131, 18-24.
- Cevik, C., Shah, N., Wilson, J.M., Stainback, R.F. Multiple Left Ventricular Thrombi in a Patient with Left Ventricular Noncompaction. Tex Heart Inst J, 2012, 39, 550-553.
- Srichai, M.B., Junor, C., Rodriguez, L.L. et al. Clinical, imaging, and pathological characteristics of left ventricular thrombus: a comparison of contrast-enhanced magnetic resonance imaging, transthoracic echocardiography, and transesophageal echocardiography with surgical or pathological validation. Am Heart J, 2006, 152, 75-84.
- Biquet, L., Lepièce, C., Hardy, S. et al. Comparison between transesophageal echocardiography and multidetector computed tomography in patients with persistent atrial fibrillation before elective external cardioversion: prospective study in a single hospital. J Interv Card Electrophysiol, 2016, 45, 321.
- Abdul-Rahim, A.H., Perez, A.C., Fulton, R.L. et al. Risk of stroke in chronic heart failure patients without atrial fibrillation: analysis of the controlled rosuvastatin in multinational trial heart failure (CORONA) and the Gruppo Italiano per lo studio della Sopravvivenza nell'Insufficienza cardiac-Heart Failure (GISSIHF) Trials. Circulation, 2015, 131, 1486-1494.
- Homma, S., Thompson, J.L.P., Pullicino, P.M. et al, Investigators W. Warfarin and aspirin in patients with heart failure and sinus rhythm. N Engl J Med, 2012, 366, 1859-1869.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.