Hartinsufficiëntie met gestoorde systolische functie is een vaak voorkomende ziekte, met een behandeling die artsen goed kennen. Toch blijft er nog controverse bestaan over de rol van anticoagulatie bij hartinsufficiëntie. We beschrijven het geval van een patiënte die een acute ischemie in de onderste ledematen kreeg na een embolie die in de linkerventrikel ontstond. Het doel van deze publicatie is een discussie aangaan over de anticoagulatie bij hartinsufficiëntie met gestoorde systolische functie. Er zijn op dit moment erg weinig literatuurgegevens, ook niet in de Europese aanbevelingen, over een behandeling met anticoagulantia bij deze patiënten.
Inleiding
We leggen een klinische casus voor van een zeldzame maar ernstige complicatie van een hartembolie bij een patiënte met een nietischemische gedilateerde cardiomyopathie met verminderde linkerventrikelejectiefractie (LVEF), van onbepaalde oorsprong (waarschijnlijk postviraal). Dankzij de chirurgische behandeling (Fogarty) van de patiënte werden de symptomen snel beter en werden onomkeerbare complicaties vermeden. Na beschrijving van het klinische beeld en de behandeling van de patiënte, zullen we het hebben over de indicaties voor een systematische anticoagulantiebehandeling bij patiënten met een lage LVEF. De Europese aanbevelingen over STEMI en cardiomyopathie geven over dit onderwerp erg weinig informatie.1, 2
Klinische observatie
Een patiënte van 44 jaar meldt zich op de spoeddienst met vermoeidheid, dyspneu van klasse NYHA III en hartkloppingen die een paar weken daarvoor voor het eerst zijn opgetreden. In haar antecedenten heeft ze vooral actief roken (60 pakjaren), hypercholesterolemie, transitoir ischemisch accident (TIA), en herhaalde miskramen (4 ×). Haar dagelijkse behandeling bestaat uit acetylsalicylzuur (Asaflow®) 80 mg 1 ×, atorvastatine (Lipitor®) 20 mg 1 ×, sotalol (Sotalex®) 160 mg 1 × onlangs begonnen, en desogestrelethinylestradiol (Marvelon®).
Uit verdere onderzoeken op de Spoeddienst blijkt het volgende:
- een goede algemene toestand en een normale BMI (153 cm voor 48 kg);
- klinische tekens van hartdecompensatie, met een bloeddruk van 100/60 mmHg, een regelmatige polsslag van 120 bpm, een geruis van mitralisinsufficiëntie, enkele crepitaties aan de longbasissen en licht oedeem van de onderste ledematen;
- een bloedtest met een BNP van 1081 pg/ml (N < 100); troponine van 13 pg/ml (N < 14), creatinine van 0,7 mg/dl (N < 1,2), normaal CRP, d-dimeren van 960 ng/ml (N < 500) en normale hepatische tests;
- op het 12 afleidingen-ecg een sinustachycardie van 122 bpm, geen tekenen van een oud infarct, en repolarisatiestoornissen;
- een echo van het hart waaruit een dilatatie van de LV blijkt, met algemene hypokinesie en een geschatte LVEF van 25 %, matige mitralisinsufficiëntie; geen tekens van pulmonale hypertensie;
- een CT-scan van de longen op de spoedafdeling maakt het mogelijk om longembolie uit te sluiten; er worden wel een verdikking van het borstvlies rechts en een grote cardiomegalie opgemerkt.
De spoedarts schrijft Lasix® (furosemide) voor à twee IV ampullen (40 mg) en de patiënte wordt opgenomen op de hartafdeling, met continue monitoring voor evaluatie. De behandeling wordt aangevuld met een ACE-remmer en een bètablokker. Bij de evaluatie wordt een ischemische cardiopathie uitgesloten, omdat de coronaire CT-scan volkomen normaal is; deze hypothese werd al gemaakt omdat er geen afwijkingen op het 12 afleidingen-ecg waren en geen akinetische zones op de echografie.
Net na het onderzoek klaagt de patiënte over hevige pijn in de twee onderste ledematen. Haar twee benen zien wit en voelen koud aan, en er wordt geen pols meer waargenomen. Het klinische onderzoek bevestigt een acute ischemie van de onderste ledematen ('de 5 P's'): pijn (intense pijn die plotseling opkomt en die optreedt in de spier voorbij de occlusie), paresthesie, paralyse, 'paleness' (wit en koud lidmaat) en afwezigheid van distale pols.
In eerste instantie wordt aan een acute bilaterale trombose in reactie op het contrastmiddel gedacht. Een embolie lijkt weinig waarschijnlijk, gezien de recente echocardiografie zonder apicale trombus en de afwezigheid van atriumfibrillatie. Onze patiënte rookt actief en neemt een hormonaal contraceptief, wat bekend is als een trombogene combinatie.
Op de Spoedafdeling wordt een dopplerechografie van de onderste ledematen uitgevoerd, die de occlusie van de twee femorale slagaders bevestigt. Er wordt snel een tweede scan uitgevoerd, en die bevestigt dat er een klonter zit in de rechter arteria femoralis communis, met een volledige afsluiting van de bloedstroom in de rechter arteria poplitea, en afsluiting van de bloedstroom in linker arteria iliaca.
De radioloog levert ons een erg recent beeld (< 1h00) met een enorme trombus in het linkervertrikel (14 × 22 × 22 mm), zichtbaar op de eerste coronaire CTangiografie (figuur 1), die bij het tweede radiologische onderzoek niet meer te zien is … De diagnose wordt dan duidelijk: een embolie in het kader van deze niet-ischemische cardiomyopathie van onbekende oorsprong (waarschijnlijk postviraal).
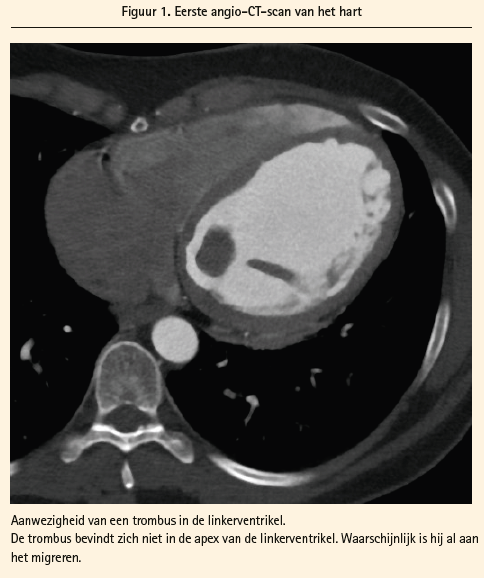
Na een chirurgische embolectomie (Fogarty) is de evolutie gunstig. Er wordt snel een anticoagulantiebehandeling voorgeschreven: LMWH in een therapeutische dosis, gevolgd door een vitamine K-antagonist (acenocoumarol-sintrom®) tot een INR van 2-3. De behandelingsduur zal afhangen van de evolutie van de cardiomyopathie onder optimale behandeling (bètablokker, ACE-remmer en spironolacton).
Bespreking
Het is bekend dat na een myocardinfarct, vooral met ST-elevatie in de voorste afleidingen (STEMI), de vorming van een trombus in het linkerventrikel een mogelijke complicatie is.1 Dat is de reden waarom een snelle reperfusie wenselijk is en er vaak na een infarct een curatieve anticoagulantie wordt aanbevolen. Er werden ook talrijke CVA's en embolieën geobserveerd bij patiënten met hartfalen, wat ook de etiologie is, vooral bij een verminderde LVEF.1, 3, 4
Stase van het bloed in het hart, wat ook de etiologie is, verhoogt het risico op vorming van een trombus. Een grote akinetische zone van de linkerventrikel, vooral in de apex, kan de oorzaak zijn voor de vorming van de klonter (figuren 2 en 3).
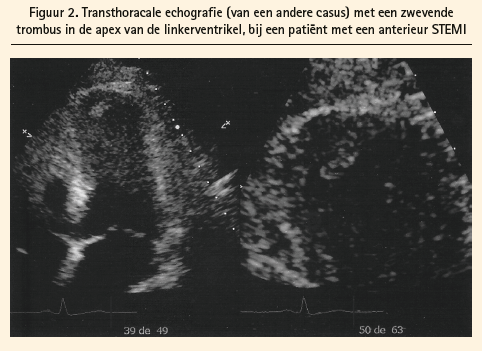
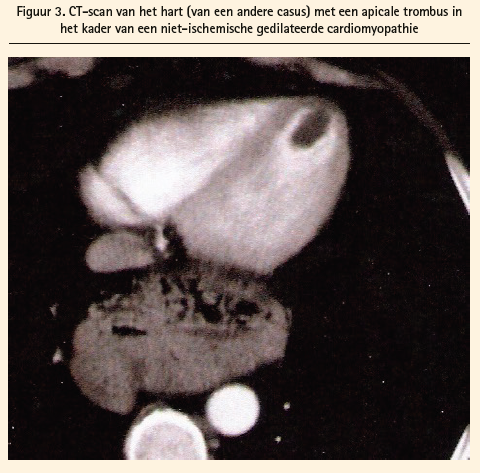
De drie voornaamste risicofactoren voor de vorming van trombi (binnen twee weken na een STEMI) in de linkerventrikel zijn:
- anterieure STEMI;
- occlusie van de ramus interventricularis anterior;
- uitgebreide STEMI met LVEF & 30 % en daaruit voortkomend ventrikelaneurysma.
Bij niet-ischemische cardiomyopathie met ventrikeldisfunctie is er ook een risico op een embolisch accident.4 De vaakst voorkomende oorzaken zijn myocarditis (viraal), toxines (alcohol), kankermedicijnen (antracycline), infiltrerende aandoeningen (amyloïdose), voedingstekorten (beriberi), of snelle atriumfibrillatie (tachycardie-geïnduceerd). Er zijn zeldzamer oorzaken gepubliceerd in de literatuur: postpartum-cardiomyopathie, syndroom van Tako-Tsubo, non-compactie van het LV.5-7
De incidentie van trombose in de linkerventrikel varieert naargelang van de reeks: van 5 % tot 25 % bij myocardinfarct en van 11 % tot 36 % bij gedilateerde myocardiopathie.3, 4
Bij patiënten met hartfalen met verminderde LVEF kan de pathogenese van trombo-embolie worden verklaard aan de hand van de virchowtriade:
- abnormale bloedstroom, ten gevolge van de dilatatie van de hartkamers en de slechte contractie van de ventrikels;
- een toestand van hypercoagulabiliteit. Patiënten met hartfalen met verminderde ejectiefractie, in sinusritme, vertonen vaak een verhoging van de bloedplaatjesactivering en van de viscositeit van het plasma;
- endotheeldisfunctie.
Een echocardiografie kan pretrombotische toestanden aan het licht brengen met de aanwezigheid van spontaan echocontrast (of 'smoke-like echoes'), te wijten aan de vertraging van de bloedsomloop en de vorming van aggregaten van bloedcellen, wat door de stase wordt bevorderd.
Merk op dat bij een niet-valvulaire atriumfibrillatie (AF) er zich een klonter kan vormen in het linkerhartoortje, door stase die het gevolg is van het feit dat er geen actieve contractie is van het hartoortje, en aan de basis kan liggen van een cerebrovasculair accident (CVA) of perifere embolie. Het pathofysiologische mechanisme is dus anders, omdat het endocard niet is aangetast en er geen endotheeldisfunctie is.
Een transthoracale echografie wordt beschouwd als de gouden standaard bij het onderzoek van de hartfunctie en het opsporen van trombi, die te zien zijn als defecten die door het contrastmiddel gescheiden worden van het myocard. Het onderzoek kan snel gebeuren, maar hangt af van de operator. De gevoeligheid van 23 % wordt beschouwd als zeer zwak.8
Hoewel de endocardiale wand met een echografie niet optimaal gevisualiseerd wordt, vooral apicaal niet, moet voor elk ander onderzoek een contrastechografie worden uitgevoerd om een trombus uit te sluiten.
Bij twijfels of bij slechte echogeniciteit moet gedacht worden aan een MRI-scan van het hart met injectie van gadolinium, ook al is dat duur en niet overal beschikbaar. In heel wat studies, o.a. van Srichai, wordt bevestigd dat een MRI blijkbaar een betere specificiteit en sensitiviteit (99 % en 88 %) heeft dan een transthoracale (96 % en 23 %) of transoesofageale echografie (96 % en 40 %) om een harttrombus op te sporen.8
Een transoesofageale echografie wordt in eerste instantie niet aanbevolen, omdat de visualisatie van de apex van de LV slecht is. Een CT-scan met contrastmiddel met een vroege en late fase zou ook een alternatief kunnen zijn om een trombus op te sporen in een hartholte. Ons team heeft duidelijk aangetoond dat een ST-scan belangrijk is om een trombus op te sporen in het linkerhartoortje voor cardioversie voor AF.9 Men moet er zich van vergewissen dat de patiënt niet allergisch is voor de contrastproducten en dat zijn nierfunctie normaal is.
Bij een intraventriculaire trombus bedraagt het risico op embolisatie bij patiënten die geen antistolling krijgen 10 à 15 % en embolen doen zich meestal voor in de eerste vier maanden. Er zijn bij een echografie twee risicofactoren op embolisatie: de mobiliteit en de protrusie van de trombus. Als er een trombus is vastgesteld, is het absoluut noodzakelijk dat de evolutie van de omvang van de klonter wordt gecontroleerd met een transthoracale echografie of een hart-MRI. Dan zal men merken dat de omvang van de trombus afneemt of gereorganiseerd wordt onder anticoagulantia. Het risico op embolisatie zal dan substantieel afnemen.
Het verdient aanbeveling om snel met een anticoagulantiebehandeling te beginnen bij patiënten die een uitgebreide anterieur STEMI hebben gehad, om te vermijden dat er zich een intraventriculaire trombus ontwikkelt. Er is evenwel nog geen enkele consensus bereikt over de vraag of we een anticoagulantiebehandeling moeten opstarten bij de andere patiënten met een hoog risico op de vorming van een trombus, zoals de personen met een LVEF lager dan 30 %, en/of een uitgebreide apicale akinesie, zoals de patiënte in deze casus.1, 3
Het risico op een trombo-embolie bij personen met AF wordt gevalideerd met de CHA2DS2-VASc-score, maar er is geen enkele vergelijkbare score beschikbaar voor patiënten met hartfalen in sinusritme. In 2015 werd in een studie geprobeerd de risicofactoren op een CVA en embolie bij deze laatsten vast te stellen, zoals leeftijd, NYHA-score, antecedenten van CVA, diabetes en BMI, maar tot nu toe is er geen enkele conclusie gevalideerd.10 Het zou interessant zijn om het onderzoek op dit vlak verder te zetten.
Bij de beslissing om een behandeling wel of niet op te starten is de baten-risicobalans altijd cruciaal. In dit precieze geval is bloeding de voornaamste zorg, vooral ook omdat patiënten met myocardinfarct al een dubbele antiplaatjesbehandeling krijgen: (aspirine + clopidogrel, ticagrelor (brilique®) of prasugrel (efient®) gedurende minimaal een jaar.
De plaatjesaggregatieremmers verhinderen helaas maar een klein deel van de vorming van intraventriculaire trombi, en vormen dan ook geen vervanging voor de klassieke anticoagulantia met vitamine K-antagonisten (VKA). Bovendien is er nog geen enkel gegeven gepubliceerd over het gebruik van NOAC's bij de preventie van de vorming van intracardiale klonters.
Ten slotte werden in een meta-analyse de effecten vergeleken van anticoagulantia van het type VKA (warfarine) met plaatjesaggregatieremmers (aspirine) bij patiënten met hartfalen in sinusritme, en in geen van beide groepen werd de vermindering van de mortaliteit of van de trombo-embolische effecten aangetoond.11 De warfarinegroep kreeg minder CVA's en embolieën, maar een groter aantal patiënten in deze groep kreeg majeure bloedingen. Daarom is er geen aanbeveling om systematisch met anticoagulantia te behandelen.
Conclusie
Bij patiënten met een hoog risico op intraventriculaire trombi verdient het aanbeveling om de voordelen en risico's van een anticoagulatie op korte en middellange termijn tegen elkaar af te wegen. Er zijn auteurs die aanraden om meteen anticoagulatie te geven bij een uitgebreid anterieur STEMI of een niet-ischemische cardiomyopathie met ernstige daling van de LVEF. De aanwezigheid van een trombus, meestal apicaal, lijkt daarentegen een formele indicatie voor VKAcoagulatie op lange termijn. Bij afwezigheid van een uitgebreid myocardinfarct of disfunctie van de linkerventrikel en wanneer er een trombus wordt ontdekt, is het wenselijk om een eventuele hypercoagulabiliteit te evalueren (cf. virchowtriade).
Referenties
- Steg, P.G., James, S.K., Atar, D. et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J, 2012, 33, 2569-2619.
- Ponikowski, P., Voors, A.A., Anker, S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2016, 37, 2129- 2200.
- Delewi, R., Zijlstra, F., Piek, J.J. Left ventricular thrombus formation after acute myocardial infarction. Heart, 2012, 98, 1743-1749.
- Gottdiener, J.S., Gay, J.A., Vanvoorhees, L., DiBianco, R., Fletcher, R. Frequency and embolic potential of left ventricular thrombus in dilated cardiomyopathy: Assessment by two-dimensional echocardiography. Am J Cardiol, 1983, 52, 1281-1285.
- Napporn, A.G., Kane, A., Damorou, J.M. et al. Intraventricular thrombosis complicating peripartum idiopathic myocardiopathy. Ann Cardiol Angeiol, 2000, 49, 309-314.
- de Gregorio, C., Grimaldi, P., Lentini, C. Left ventricular thrombus formation and cardioembolic complications in patients with Tako-Tsubo-like syndrome: a systematic review. Int J Cardiol, 2008, 131, 18-24.
- Cevik, C., Shah, N., Wilson, J.M., Stainback, R.F. Multiple Left Ventricular Thrombi in a Patient with Left Ventricular Noncompaction. Tex Heart Inst J, 2012, 39, 550-553.
- Srichai, M.B., Junor, C., Rodriguez, L.L. et al. Clinical, imaging, and pathological characteristics of left ventricular thrombus: a comparison of contrast-enhanced magnetic resonance imaging, transthoracic echocardiography, and transesophageal echocardiography with surgical or pathological validation. Am Heart J, 2006, 152, 75-84.
- Biquet, L., Lepièce, C., Hardy, S. et al. Comparison between transesophageal echocardiography and multidetector computed tomography in patients with persistent atrial fibrillation before elective external cardioversion: prospective study in a single hospital. J Interv Card Electrophysiol, 2016, 45, 321.
- Abdul-Rahim, A.H., Perez, A.C., Fulton, R.L. et al. Risk of stroke in chronic heart failure patients without atrial fibrillation: analysis of the controlled rosuvastatin in multinational trial heart failure (CORONA) and the Gruppo Italiano per lo studio della Sopravvivenza nell'Insufficienza cardiac-Heart Failure (GISSIHF) Trials. Circulation, 2015, 131, 1486-1494.
- Homma, S., Thompson, J.L.P., Pullicino, P.M. et al, Investigators W. Warfarin and aspirin in patients with heart failure and sinus rhythm. N Engl J Med, 2012, 366, 1859-1869.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.