C'est à l'occasion du symposium satellite 'Genetic diseases in cardiology: approach in your daily practice' que le sujet des maladies cardiaques rares a été abordé lors de ce 37ème congrès de la BSC. Pour ce faire, nous avons eu la chance de recevoir deux orateurs de renom dans le domaine, le Professeur P. Elliott et le Professeur A. Linhart, qui ont animé le débat avec le Professeur Julie de Backer et le Professeur Antoine Bondue, modérateurs de cette session.
The cardiologist facing rare diseases in clinical practice: be aware!
Le Professeur P. Elliott a fait le déplacement de l'University College London du Royaume Uni pour nous conscientiser à l'importance d'évoquer un diagnostic de maladie cardiaque 'rare' face à un patient présentant des manifestations 'atypiques'. Il insiste sur le fait que tout cardiologue peut potentiellement rencontrer des maladies rares dans sa pratique quotidienne, soulignant la nécessité de les connaître et d'y être attentif.
Le Professeur Elliott a débuté son exposé en nous rappelant un paradoxe important face aux maladies rares: alors qu'une maladie est considérée comme rare dès lors qu'elle affecte moins d'une personne sur 2 000, le nombre de maladies rentrant dans cette catégorie est relativement important, si bien que jusqu'à 8 % de la population pourrait souffrir d'une telle maladie 'rare'. Ainsi, en Europe, nous recensons entre 5 000 et 8 000 maladies 'rares', lesquelles touchent au total jusqu'à 36 millions de personnes! La plupart d'entre-elles (80 %) sont d'origine génétique, évoluent sur un mode chronique et peuvent conduire au décès: ce sont donc des maladies potentiellement sévères. Retenons que trois quarts des patients présentent des symptômes dès leur enfance, et que l'apparition précoce de symptômes doit attirer l'attention vers une maladie rare. Une caractéristique clinique des maladies 'rares' à l'heure actuelle en est leur diagnostic tardif, principalement par manque de connaissance ou d'attention vis-à-vis d'elles, par manque d'évaluation clinique familiale au-delà du patient, et par une réorientation souvent tardive vers les centres de référence.
Des données statistiques parues en 2012 dans le JACC1 nous rappellent que plus de la moitié des décès par maladies acquises sont d'origine cardiovasculaire dans les pays développés. Ces dernières sont fortement liées à la présence de facteurs de risque bien identifiés, et que leur prise en charge, associé aux campagnes de prévention efficaces, ont permis une nette diminution de l'incidence des pathologies cardiovasculaires ces 30 dernières années.
Est-il dès lors justifié de rechercher activement ces maladies rares et héréditaires? C'est à travers quelques exemples cliniques que le Professeur Elliott arrive subtilement à nous convaincre. Pour lui, le challenge réside dans l'identification des patients souffrant d'une maladie cardiaque 'rare' et potentiellement héréditaire parmi l'ensemble des cas rencontrés en clinique quotidienne. Face à une maladie 'rare', une histoire familiale est parfois retrouvée, mais une présentation 'sporadique' n'exclut pas une maladie héréditaire! Par exemple, pour la cardiomyopathie dilatée (CMD), des mutations dans plus de 50 gènes y sont associées à ce jour, avec une hérédité mendélienne pour la majorité des cas. Lors de la réalisation d'un dépistage clinique systématique chez les proches de patients souffrant d'une CMD d'allure 'sporadique', on détecte jusqu'à 15-25 % d'atteintes cliniques ou infracliniques chez les proches (selon le critère diagnostic utilisé et la population étudiée), témoignant de la présence d'une affection en fait 'héréditaire'. à ce jour, dans l'état actuel des connaissances, une mutation peut être identifiée chez 48 % des patients atteints d'une CMD en présence d'antécédents familiaux, contre 24 % dans les cas de présentation 'sporadiques', selon un registre finlandais récent2. Ces données sont confirmées à une plus grande échelle dans le registre européen3, témoignant d'une importante composante génétique dans la survenue d'une cardiomyopathie dilatée, avec cependant une pénétrance incomplète (soulignant l'importance de facteurs modulateurs tels l'environnement, le mode de vie, les modifications épigénétiques ou des gènes modulateurs).
En clinique, il est important de reconnaître certaines manifestations 'phares', appelées en anglais 'red flags' permettant de mettre sur la piste d'une affection héréditaire ou de certaines mutations. Bien que les guidelines de prise en charge de l'insuffisance cardiaque soient d'excellente qualité, ils se limitent dans la recherche étiologique aux pathologies classiques en évoquant moins volontiers les maladies héréditaires. Le clinicien doit dès lors creuser son anamnèse et garder l'oeil aguerri aux signes évocateurs d'une atteinte génétique (jeune âge, antécédents familiaux, caractéristiques échocardiographiques, comorbidités associées, manifestations extracardiaques ...) afin de cibler les malades pour lesquels une mise au point complémentaire est justifiée. Certaines mutations amènent un décours clinique particulier: les mutations de la Lamin A/C4 ou de la FLNC5 entraînent par exemple une risque rythmique important, justifiant une prise en charge plus agressive de ces patients sur le plan rythmique. De cet exemple naît le concept de 'médecine stratifiée' ou 'personnalisée' qui implique l'identification des sous-groupes de patients qui pourraient bénéficier d'un traitement plus spécifique afin d'améliorer leur devenir.
Pour permettre un diagnostic adéquat de ces maladies'rares' (mais en fait fréquentes dans leur ensemble), il est essentiel que chacun de nous y soit attentif. Une évaluation de la dimension familiale, la reconnaissance de signes d'appels et une investigation clinique attentive (cherchant toujours à expliquer une symptomatologie 'atypique') permettront d'identifier une maladie 'rare' dans notre pratique quotidienne. La génétique de ces maladies étant souvent complexe, une étroite collaboration avec les centres de génétique est par ailleurs nécessaire pour permettre un diagnostic adéquat et une prise en charge optimale de ces patients et de leur famille.
Emerging therapies for hereditary cardiomyopathies
La seconde session de ce symposium fut présentée par le Prof. Linhart A. de l'University Hospital de Prague. à l'instar de son prédécesseur, les premières minutes de son exposé furent consacrées à l'importance capitale que doit apporter chaque clinicien à la recherche de signes évocateurs d'une maladie rare, avant d'aborder les nouvelles approches thérapeutiques pour ces patients.
Toute mise au point cardiologique comporte des examens de base (ECG et échocardiographie), et devrait inclure une anamnèse personnelle et familiale qui se doit d'être la plus complète possible. Cette dernière, couplée à un examen physique approfondi, permettra d'identifier un pattern héréditaire et/ou de mettre en évidence des atteintes cardiaques ou extracardiaques chez le patient et ses proches. Après, divers examens complémentaires vont permettre de progresser vers le diagnostic final.
La mise au point diagnostique
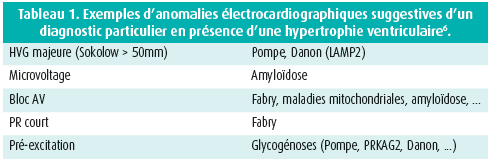
Une analyse fine de l'électrocardiogramme permet souvent d'évoquer certaines étiologies en présence de caractéristiques particulières. Un exemple est donné dans le tableau 1 pour l'hypertrophie ventriculaire.
La réalisation d'un arbre généalogique est un élément essentiel pour identifier le mode de transmission des maladies héréditaires, et demeure un indice capital en faveur de certains diagnostics. Rappelons par exemple que la maladie de Fabry et de Danon sont caractérisées par une transmission liée au chromosome X, alors que les maladies mitochondriales sont principalement transmises par la mère.
Une attention particulière doit être apportée aux atteintes extracardiaques, parfois très invalidantes mais souvent discrètes et d'installation progressive. Elles peuvent toucher n'importe quel organe et peuvent être notamment cutanées, neurologiques, ophtalmiques ou même biologiques. Leur identification permettra d'orienter vers une hypothèse diagnostique plutôt qu'une autre, et leur identification constitue une étape clé du diagnostic. Le tableau 2 reprend une liste non exhaustive de ces dernières en cas d'hypertrophie ventriculaire.

Alors que l'échocardiographie constitue une pierre angulaire pour le diagnostic des cardiomyopathies, l'IRM cardiaque a acquis une place de choix en renseignant de manière non invasive sur des caractéristiques tissulaires du myocarde et sur des éléments fonctionnels. L'IRM cardiaque permet entre autres de calculer des volumes ventriculaires et d'évaluer la fonction ventriculaire de façon fiable. L'injection de gadolinium permet d'évaluer des modifications tissulaires et notamment de localiser les zones de fibrose par la visualisation d'un rehaussement tardif (Late Gadolinium Enhancement ou LGE) qui résulte d'une augmentation significative du temps de lavage des cellules fibrotiques par rapport au tissu sain. Pour exemple, alors que la fibrose consécutive à un infarctus se répartit selon l'anatomie coronaire, les cardiomyopathies non ischémiques ont des caractéristiques de réhaussement qui leur sont propres7, 8.
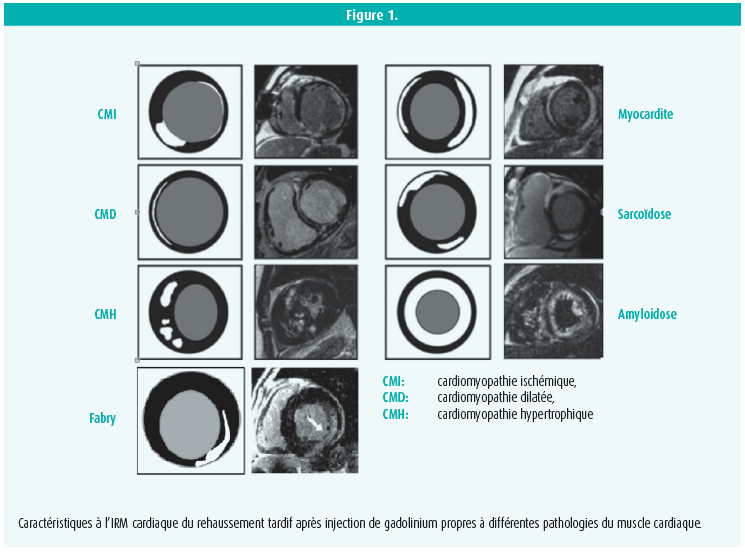
Le Prof. Linhart mentionnera également l'apport conséquent de la technique du T1-mapping qui permet d'approcher le diagnostic différentiel des cardiomyopathies via une analyse des caractéristiques tissulaires intrinsèques ou après injection de gadolinium du myocarde. Cette technique particulièrement prometteuse permet (outre le calcul du volume extracellulaire) d'identifier des patterns spécifiques pour différentes étiologies de cardiomyopathies, permettant quasi une 'histologie' non invasive du tissu myocardique. Ces techniques innovantes autorisent bien à ne plus avoir recours à une biopsie myocardique9, 10.
Les thérapies ciblées
Par une meilleur compréhension des mécanismes moléculaires, l'identification d'une mutation dans une voie métabolique ou affectant un processus physiologique permet d'entrouvrir la possibilité de développer des thérapies 'ciblées', contrant alors l'évolution naturelle de certaines maladies rares. Notre orateur prendra trois pathologies en exemple pour lesquelles ce type de traitement existe.
La maladie de Pompe est une maladie métabolique liée à l'accumulation tissulaire de glycogène résultant du déficit en alpha-1,4-glucosidase acide (enzyme lysosomiale qui hydrolyse le glycogène en glucose). Sa transmission est autosomique récessive. En l'absence de traitement, les formes infantiles conduisent au décès par insuffisance cardiaque ou respiratoire endéans la première année de vie, liée au développement d'une importante hypertrophie ventriculaire gauche, d'une faiblesse musculaire et d'une hypotonie. Les formes adultes, dont l'évolution est moins rapide (de par la présence d'une activité enzymatique résiduelle), sont caractérisées par une fatigabilité musculaire progressive pouvant atteindre également les muscles respiratoires. L'atteinte cardiaque est marquée par la présence d'une cardiomyopathie hypertrophique menant à de l'insuffisance cardiaque. La mesure de l'activité enzymatique permet d'évoquer le diagnostic par la démonstration d'une activité de maltase acide réduite, et des analyses génétiques permettent de le confirmer. De nos jours, les avancées de la biologie moléculaire ont permis l'élaboration d'une enzyme recombinante humaine, disponible sur le marché depuis 2006, qui améliore la qualité et l'espérance de vie des patients et permet une quasi réversion du phénotype au niveau tissulaire.
La maladie de Fabry, dont la transmission est cette fois lié au chromosome X, fait suite à un déficit en alpha-galactosidase lysosomiale (GLA). Il en résulte une accumulation intracellulaire de sphingolipides, entraînant une dysfonction de nombreux organes et faisant de cette maladie une maladie 'systémique'. Les manifestations cliniques sont souvent hétérogènes et difficiles à identifier. Classiquement, les hommes sont plus atteints mais des manifestations sont également possible chez des femmes (souvent plus tardivement). Aussi, le degré de sévérité et la rapidité de l'apparition des symptômes sont fort variables compte tenu de l'hétérogénéité des mutations possibles et du niveau variable d'activité résiduelle qui en découle. Classiquement, les premières manifestations apparaissent chez le jeune garçon sous la forme de douleurs aux extrémités, parfois associées à des lésions vasculaires sur le torse ou en région péri-ombilicale. L'atteinte rénale est fréquente chez le jeune adulte et conduit volontiers à de l'insuffisance rénale terminale, avec une protéinurie importante. Les complications cardiovasculaires conditionnent le pronostic avec l'apparition d'une hypertrophie ventriculaire gauche responsable de troubles du rythme et/ ou évoluant vers de l'insuffisance cardiaque. Il est intéressant de se rappeler que l'atteinte cardiaque est parfois préférentiellement localisée dans la région postérolatérale, donnant alors à l'IRM un rehaussement tardif relativement caractéristique. Aussi le signal de la maladie de Fabry en 'T1-mapping' se démarque d'autres pathologies, et cette technique est reconnue comme une méthode de choix pour évoquer un diagnostic de maladie de Fabry. Les atteintes vasculaires cérébrales (lésions de la substance blanche) ne sont pas rares. L'atteinte ophtalmique est caractérisée par la présence d'une cornée verticillée (comme pour la toxicité de l'amiodarone). Chez les hommes, le diagnostic repose sur le dosage de l'activité enzymatique de l'alphagalactosidase, diagnostic qui sera confirmé ensuite par un séquençage du gène GLA. Chez la femme, par la présence d'une activité enzymatique souvent moins altérée (de par la présence d'une compensation liée à l'autre chromosome X), le diagnostic repose en première ligne sur le séquençage du gène GLA. Un traitement substitutif par enzyme recombinante administrée en intraveineux bimensuellement est disponible depuis le début des années 2000. Il permet une amélioration de la symptomatologie, et une protection sur le plan cardiaque et rénal, améliorant également le pronostic et la qualité de vie de ces patients. Le bénéfice en est d'autant plus important que la prise en charge est précoce, soulignant l'importance d'un diagnostic précoce. Plus récemment, une molécule permettant une stabilisation moléculaire de l'enzyme déficiente a été développée, utilisant la technique des protéines 'Chaperones' pour stabiliser l'enzyme endogène. Cette thérapie offre l'avantage d'être administrable par voie entérale. Enfin, des thérapies géniques ciblant directement la mutation concernée ou stabilisant les transcrits sont en cours d'évaluation chez l'homme après avoir montré des résultats encourageants chez la souris.
L'amyloïdose TTR (autosomique dominante) se développe chez les patients âgés, ou chez des patients d'âge moyen présentant alors une mutation du gène codant pour la transthyrétine, une protéine synthétisée par le foie. L'accumulation tissulaire de dépôts amyloïdes cause les différentes dysfonctions organiques (principalement neurologique périphérique, rénale et cardiaque). L'atteinte cardiaque peut être sévère et est caractérisée par une hypertrophie ventriculaire gauche pouvant mener à de l'insuffisance cardiaque et fait courir au patient un risque de mort subite. L'ECG est classiquement microvolté ou peut présenter des pseudoséquelles électriques (inconstant). L'IRM cardiaque montre des altérations du rehaussement tardif, préférentiellement sur un mode circonférentiel dans la région sous-endocardique. De manière intéressante pour le diagnostic, la scintigraphie osseuse utilisant des marqueurs phosphatés fixe au niveau myocardique, un signe hautement suggestif d'une amyloïdose TTR. Jusqu'il y a peu le traitement était principalement supportif (pouvant aller jusqu'à la transplantation cardiaque ou rénale) ou causal (par la transplantation hépatique); mais depuis peu, certaines molécules sont développées afin d'enrayer l'accumulation de ces dépôts amyloïdes. Ces nouvelles molécules interfèrent soit avec la stabilité et la solubilité de la protéine TTR mutée (ex le tafamidis), soit diminuent la production de la protéine TTR par interférence avec l'ARN messager (ex patisiran ou diflunisal). De nombreuses études sont actuellement en cours pour évaluer le bénéfice cardiologique potentiel de ces molécules.
Globalement, à travers ces quelques exemples, le Prof Linhart nous a illustré qu'une meilleure compréhension des mécanismes physiopathologies des maladies rares permet le développement de nouvelles stratégies thérapeutiques, et qu'il est essentiel de poser un diagnostic précoce et adéquat pour ces patients, leur permettant de bénéficier de tels traitements.
Références
- Laslett, L.J. et al. The worldwide environment of cardiovascular disease: prevalence, diagnosis, therapy, and policy issues: a report from the American College of Cardiology. J Am Coll Cardiol, 2012, 60 (25 Suppl): S1-49.
- Akinrinade, O. et al. Genetics and genotype- phenotype correlations in Finnish patients with dilated cardiomyopathy. Eur Heart J, 2015, 36 (34), 2327-2337.
- Haas, J. et al. Atlas of the clinical genetics of human dilated cardiomyopathy. Eur Heart J, 2015, 36 (18), 1123-1135a.
- van Rijsingen, I.A. et al. Risk factors for malignant ventricular arrhythmias in lamin a/c mutation carriers a European cohort study. J Am Coll Cardiol, 2012, 59 (5), 493-500.
- Ortiz-Genga, M.F. et al. Truncating FLNC Mutations Are Associated With High-Risk Dilated and Arrhythmogenic Cardiomyopathies. J Am Coll Cardiol, 2016, 68 (22), 2440-2451.
- Elliott et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. Eur Heart J, 2014, 35 (39), 2733-2779.
- Moon, J.C. et al. Gadolinium enhanced cardiovascular magnetic resonance in Anderson- Fabry disease. Evidence for a disease specific abnormality of the myocardial interstitium. Eur Heart J, 2003, 24 (23), 2151-2155.
- White, J.A., Patel, M.R. The role of cardiovascular MRI in heart failure and the cardiomyopathies. Cardiol Clin, 2007, 25 (1), 71-95.
- Ugander, M. et al. Extracellular volume imaging by magnetic resonance imaging provides insights into overt and sub-clinical myocardial pathology. Eur Heart J, 2012, 33 (10), 1268-1278.
- Taylor, A.J. et al. T1 Mapping: Basic Techniques and Clinical Applications. JACC Cardiovasc Imaging, 2016, 9 (1), 67-81.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.