Dépistage non invasif ou évaluation invasive des sténoses coronariennes ?
Ces 100 dernières années, la pierre angulaire du traitement des atteintes coronariennes reposait sur le constat d'une ischémie myocardique. Il a été démontré en 2003 que la charge ischémique détermine le pronostic et que la valeur seuil est fixée à environ > 10 % d'ischémie myocardique à la scintigraphie pour une influence favorable de la revascularisation sur le taux de mortalité en comparaison d'un traitement médicamenteux1.
Cependant, l'étude COURAGE n'a pas permis de démontrer une différence de mortalité après 10 années de suivi lorsque le traitement médical optimal (OMT) était comparé avec une association d'OMT et de revascularisation percutanée (PCI) chez des patients présentant une sténose coronaire constatée a posteriori lors d'une exploration invasive2. De même, la récente étude ISCHEMIA, qui a inclus des patients présentant une ischémie modérée à sévère diagnostiquée par une épreuve d'effort, n'a pas non plus permis de démontrer une différence de mortalité entre le groupe conservateur (OMT) et le groupe invasif (OMT + PCI)3. Le débat concernant d'autres critères d'évaluation forts, comme les infarctus périprocéduraux et les infarctus tardifs, donnera encore certainement lieu à une discussion animée. La sélection des patients sur la base de tests fonctionnels non invasifs s'avère donc insuffisante pour identifier les patients qui tireront bénéfice d'une revascularisation percutanée invasive.
Ces 20 dernières années, l'évaluation fonctionnelle invasive sur la base de la fraction de flux de réserve (FFR) a été étudiée dans des RCT, la stratégie PCI guidée par la mesure de la FFR s'étant révélée associée à de plus faibles taux de MACE que le traitement médical seul4. De ce fait, les recommandations ont confirmé la fonction de la technique FFR en tant que référence dans la décision clinique d'un éventuel traitement percutané pour un syndrome coronarien chronique5.
La FFR exprime le ratio entre la pression intracoronaire distale et la pression aortique en cours d'hyperémie. La FFR est donc un paramètre spécifique vasculaire qui fait office de substitut de l'ischémie6. Il faut noter que, dans la récente étude ISCHEMIA, 20 % seulement des patients étaient évalués au moyen d'examens fonctionnels invasifs lorsqu'une sténose coronaire était constatée3. Dans l'étude COURAGE, aucune mesure invasive de la pression par FFR n'était réalisée7.
Dans la pratique clinique, la décision de procéder à une éventuelle revascularisation se prend sur la base d'une valeur de FFR mesurée distalement. La valeur seuil dichotomique se situe à 0,80 bien que la FFR montre une relation linéaire, les lésions associées à de plus faibles valeurs de FFR présentant le plus grand bénéfice absolu après revascularisation8.
La pratique actuelle : la luminographie devient mesure de pression
Une coronarographie de routine est à strictement parler une 'luminographie', après laquelle l'interprétation visuelle de la sévérité d'une sténose conduit ou non à une revascularisation percutanée. L'évaluation de la gravité des sténoses coronaires lors d'une coronarographie conventionnelle est cependant compliquée par la relation équivoque entre, d'une part, l'angiographie et l'imagerie intravasculaire en ce qui concerne l'évaluation de l'étendue et de la gravité d'une CAD, et, d'autre part, la gravité anatomique visuelle d'une CAD et les répercussions fonctionnelles physiologiques de la/ des sténose(s) mesurée(s) pendant l'évaluation fonctionnelle invasive9, 10. En effet, les clichés IVUS et OCT ont démontré que la gravité et la distribution de la CAD sont sous-estimées. Même les patients qui ont des vaisseaux épicardiques apparemment 'normaux' présentent souvent une athérosclérose diffuse, qui s'accompagne parfois d'une restriction du flux sanguin11. Chez ces patients, l'évaluation fonctionnelle invasive par mesure de la FFR peut contribuer à déterminer l'ampleur des répercussions de l'athérosclérose. Une coronaropathie (CAD) plus marquée peut se présenter sous la forme d'une atteinte anatomique tantôt focale, tantôt diffuse. Mais il n'existe à ce jour aucun consensus, ni aucune manière de quantifier une CAD diffuse. La distribution des répercussions fonctionnelles du profil pathologique anatomique peut être déterminée par la technique de pullback. Un pullback motorisé à vitesse fixe offre en outre la possibilité de 'colocaliser' la répercussion fonctionnelle avec le profil pathologique anatomique (CAD focale vs CAD diffuse)12 (figure 1).
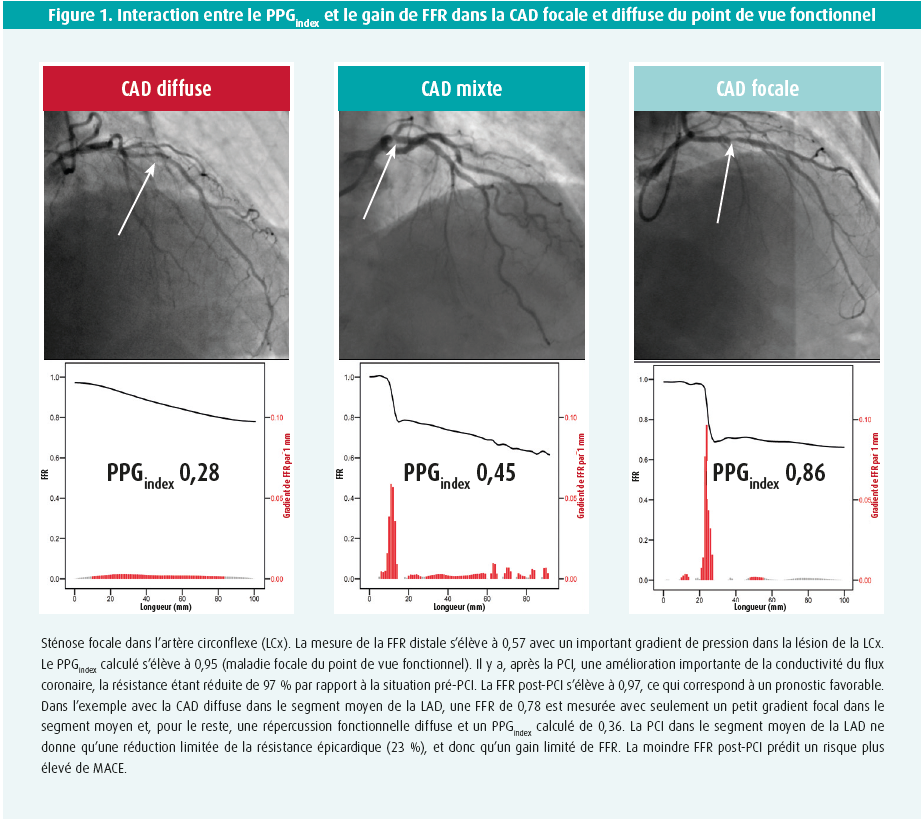
L'intérêt pronostique d'une évaluation fonctionnelle
L'identification du profil fonctionnel de la CAD revêt aussi une potentielle importance pour le pronostic. Le traitement d'une maladie focale ou diffuse conduit souvent à un bénéfice différent en termes de conductivité des artères coronaires (ledit 'FFR gain'). Le gain en termes de conduction du flux coronaire se reflète dans la mesure de la FFR post-PCI. Plus la valeur de FFR mesurée après la revascularisation est élevée, plus le pronostic du patient est favorable13, 14. Une sous-étude nucléaire de COURAGE a, elle aussi, démontré que les patients ayant ≥ 5 % de réduction de l'ischémie à la scintigraphie myocardique présentaient un meilleur pronostic après la PCI par rapport au traitement médical15. Une description physiopathologique du profil de l'atteinte coronarienne, focale ou diffuse, peut donc de cette manière conduire à une optimisation de nos stratégies de traitement et peut donc avoir une influence directe sur le gain physiologique de capacité de conduction coronaire atteint pendant une implantation de stent par voie percutanée (figure 2). Dans ce texte, nous décrivons le développement d'un nouvel indice qui quantifie la résistance épicardique et qui aide ainsi à différencier la maladie focale de la maladie diffuse.
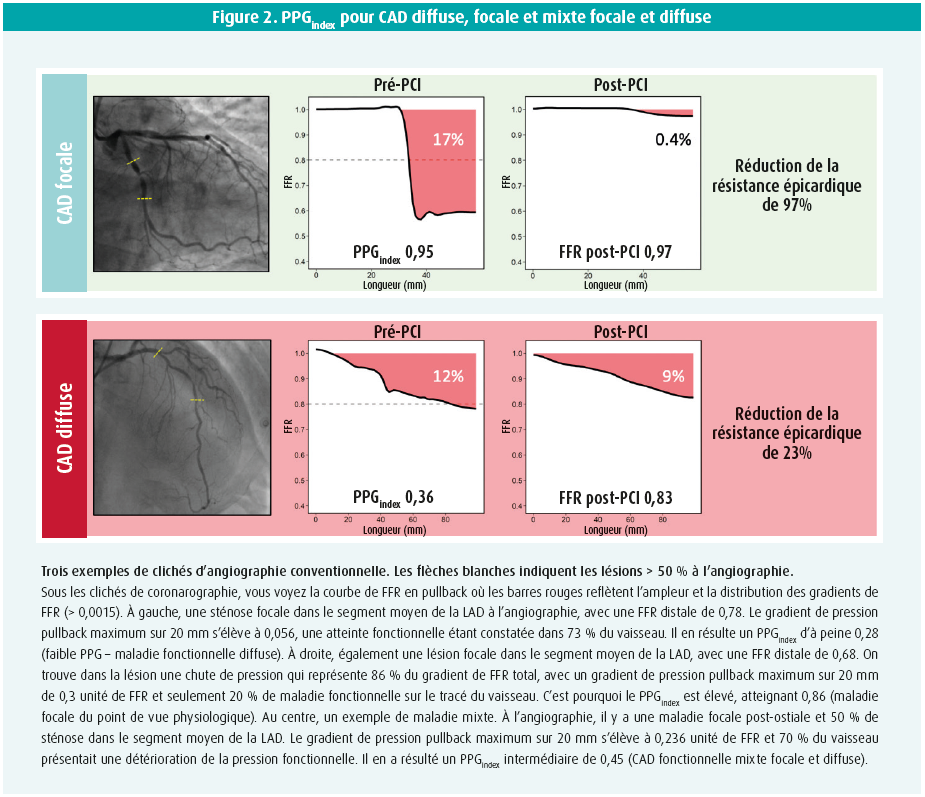
Le nouveau 'Pullback Pressure Gradient Index' hyperémique
Fin 2019, Collet et Sonck ont décrit les résultats d'une étude prospective multicentrique, contrôlée, dans laquelle des patients avec une indication de coronarographie ont subi une mesure de la FFR de lésions intermédiaires (sténose de 30-70 %). Pendant la mesure de la FFR, un pullback motorisé était exécuté pendant l'administration IV continue d'adénosine (140 mcg/kg/min). Dans une étude antérieure, la technique du pullback motorisé s'était révélée précise et reproductible pour l'évaluation de la résistance épicardique. Dans cette étude, le pullback motorisé était réalisé à une vitesse de 1 mm/s. Toutes les 10 ms, une valeur de FFR était extraite du tracé de pression et les courbes de FFR mesurées en technique pullback étaient calculées avec un algorithme informatique. Au départ de ces courbes de FFR, on a créé une classification quantitative du profil fonctionnel de CAD sur la base des gradients de pression pullback (PPG). Deux paramètres sont utilisés pour calculer le PPGindex : premièrement, le PPG maximum sur 20 mm, représentatif de l'ampleur de la chute de FFR, et deuxièmement, la longueur des segments épicardiques avec atteinte fonctionnelle ou déclin de FFR (déclin de FFR > 0,0015/ mm), ce qui décrit l'étendue de la maladie. Le PPGindex est alors calculé comme suit :
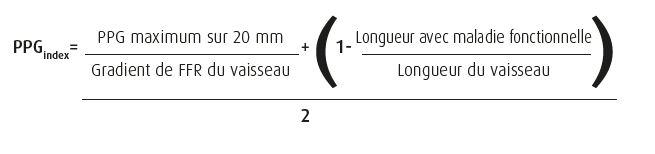
Le PPGindex est un indice continu, dans lequel les valeurs proches de 1 représentent une maladie focale du point de vue fonctionnel et les valeurs proches de 0, une CAD diffuse hémodynamique.
Pour l'étude, les profils de CAD anatomiques angiographiques et les courbes de FFR mesurées en pullback ont été classés en focal, diffus ou une association des deux. Pour ce faire, les lésions anatomiques et les courbes de FFR mesurées en pullback motorisé ont été co-enregistrées. Tous les patients inclus dans l'étude ont bénéficié d'un suivi clinique et les événements périprocéduraux ont également été adjugés par un 'clinical events committee' indépendant. Au total, 111 patients et 158 vaisseaux ont été étudiés16.
Lorsque la coronarographie conventionnelle était évaluée, 62 % des CAD ont été considérées comme focales, 27 % comme diffuses et 11 % comme un mix de CAD focale et diffuse moyennant un degré d'accord interobservateurs modéré (kappa de Cohen de 0,39). Après interprétation des courbes de FFR mesurées en pullback, les observateurs ont établi 50 % de maladie focale, 22 % de maladie diffuse et 28 % de maladie mixte moyennant un degré d'accord interobservateurs clairement plus élevé (kappa de Cohen de 0,75). En comparaison de l'évaluation par angiographie conventionnelle du profil de CAD, 36 % des CAD ont donc été reclassifiées sur la base des résultats des FFR mesurées en pullback motorisé. Cela signifie que 30 % des maladies focales du point de vue anatomique ont été reclassifiées en maladies diffuses ou mixtes. À l'inverse, 13 % des patients avec une maladie diffuse du point de vue anatomique ont été reclassifiés en maladie focale du point de vue fonctionnel. Une description quantitative du profil de CAD a ainsi été proposée pour la première fois16.
Implications cliniques du PPGindex
Le PPGindex offre pour la première fois une quantification objective du profil de CAD là où, jusqu'à présent, il n'existait même pas de définition uniforme de la maladie coronarienne diffuse. Les pullbacks de FFR qui étaient exécutés jusqu'à aujourd'hui ne permettaient en outre qu'une interprétation visuelle, ce qui introduit également un biais.
L'identification des CAD focales et diffuses détermine la stratégie de revascularisation au laboratoire de cathétérisme. Les patients atteints d'une maladie diffuse seront peut-être de préférence traités par une médication plutôt que par une revascularisation chirurgicale. Mais, pour une maladie coronarienne focale, une revascularisation percutanée est éventuellement indiquée. Le PPGindex peut ainsi éviter les interventions percutanées associées à un faible bénéfice physiologique (i.e. dans la maladie diffuse). Dans la pratique clinique, nous observons en effet qu'un taux allant jusqu'à 30 % des patients présentent, après une PCI, un résultat infraoptimal en termes de FFR17, 18. Une détermination additionnelle du PPGindex après la mesure distale classique de la FFR offre la possibilité d'optimiser la sélection des patients pour une revascularisation percutanée et d'atteindre un bénéfice optimal en termes de restauration du flux coronaire.
Qui plus est, les patients souffrant d'une atteinte focale et présentant des gradients trans-sténotiques élevés sont potentiellement exposés à un risque accru d'événements coronariens aigus. Cette hypothèse a déjà été décrite précédemment, dans l'étude EMERALD, sur la base du scanner coronaire et de la modélisation des gradients trans-sténotiques selon la mécanique des fluides numériques19. Dans notre étude, nous avons vu que les patients avec un PPGindex élevé présentaient un taux de MACE inférieur, la différence n'atteignant pas le seuil de signification statistique. Chez les patients à faible PPGindex, des valeurs de troponine post-revascularisation supérieures ont été mesurées, ce qui s'explique potentiellement par le plus grand nombre de stents et la plus grande longueur de stent nécessaires pour traiter une CAD diffuse.
L'avenir du PPGindex
On publiera bientôt les résultats qui reflètent l'interaction entre le profil de CAD, tel que décrit par le PPGindex, et le gain de capacité de conduction coronaire post-PCI (FFR post-PCI). Par ailleurs, les résultats qui décrivent la reproductibilité du PPGindex pendant un pullback manuel seront publiés sous peu. D'un point de vue pratique, ces pullbacks manuels sont plus faciles à réaliser. L'autre avantage est qu'ils ne doivent pas être exécutés pendant l'administration continue d'adénosine, ce qui facilite considérablement le tracé de la courbe de FFR mesurée en pullback et le calcul du PPGindex par rapport à la technique du pullback motorisé décrite dans cette étude. Dans un proche avenir, il deviendra possible de calculer le 'Pullback Pressure Gradient Index' (PPGindex) en ligne, pendant la coronarographie (figure 3).
Références
- Hachamovitch, R., Hayes, S.W., Friedman, J.D., Cohen, I., Berman, D.S. Comparison of the short-term survival benefit associated with revascularization compared with medical therapy in patients with no prior coronary artery disease undergoing stress myocardial perfusion single photon emission computed tomography. Circulation, 2003, 107 (23), 2900-2907.
- Sedlis, S.P., Hartigan, P.M., Teo, K.K., et al. Effect of PCI on Long-Term Survival in Patients with Stable Ischemic Heart Disease. N Engl J Med, 2015, 373 (20), 1937-1946.
- Maron, D.J., Hochman, J.S., Reynolds, H.R., et al. Initial Invasive or Conservative Strategy for Stable Coronary Disease. N Engl J Med, 2020, doi:10.1056/NEJMoa1915922.
- Xaplanteris, P., Fournier, S., Pijls, N.H.J., et al. Five-Year Outcomes with PCI Guided by Fractional Flow Reserve. N Engl J Med, 2018, NEJMoa1803538.
- Knuuti, J., Wijns, W., Saraste, A., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J, 2020, 41 (3), 407-477.
- Pijls, N.H., De Bruyne, B., Peels, K., et al. Measurement of fractional flow reserve to assess the functional severity of coronary-artery stenoses. N Engl J Med, 1996, 334 (26), 1703-1708.
- Boden, W.E., O'Rourke, R.A., Teo, K.K., et al. Optimal Medical Therapy with or without PCI for Stable Coronary Disease. N Engl J Med, 2007, 356 (15), 1503-1516.
- Johnson, N.P., Tóth, G.G., Lai, D., et al. Prognostic Value of Fractional Flow Reserve: Linking Physiologic Severity to Clinical Outcomes. J Am Coll Cardiol, 2014, 64 (16), 1641-1654.
- Meneveau, N., Souteyrand, G., Motreff, P., et al. Optical Coherence Tomography to Optimize Results of Percutaneous Coronary Intervention in Patients with Non-ST-Elevation Acute Coronary Syndrome: Results of the Multicenter, Randomized DOCTORS Study (Does Optical Coherence Tomography Optimize Results of Stenting). Circulation, 2016, 134 (13), 906-917.
- Mintz, G.S., Painter, J.A., Pichard, A.D., et al. Atherosclerosis in angiographically “normal” coronary artery reference segments: An intravascular ultrasound study with clinical correlations. J Am Coll Cardiol, 1995, 25 (7), 1479-1485.
- De Bruyne, B., Hersbach, F., Pijls, N.H., et al. Abnormal epicardial coronary resistance in patients with diffuse atherosclerosis but 'normal' coronary angiography. Circulation, 2001, 104 (20), 2401-2406.
- Sonck, J., Collet, C., Mizukami, T., et al. Motorized fractional flow reserve pullback: Accuracy and reproducibility. Cathet Cardiovasc Interv, 2020. doi:10.1002/ccd.28733.
- Pijls, N.H.J., Klauss, V., Siebert, U., et al. Coronary pressure measurement after stenting predicts adverse events at follow-up: a multicenter registry. Circulation, 2002, 105 (25), 2950-2954.
- Piroth, Z., Toth, G.G., Tonino, P.A.L., et al. Prognostic Value of Fractional Flow Reserve Measured Immediately After Drug-Eluting Stent Implantation. Circ Cardiovasc Interv, 2017, 10 (8), e005233.
- Shaw, L.J., Berman, D.S., Maron, D.J., et al. Optimal Medical Therapy With or Without Percutaneous Coronary Intervention to Reduce Ischemic Burden. Circulation, 2008, 117 (10), 1283-1291.
- Collet, C., Sonck, J., Vandeloo, B., et al. Measurement of Hyperemic Pullback Pressure Gradients to Characterize Patterns of Coronary Atherosclerosis. J Am Coll Cardiol, 2019, 74 (14), 1772-1784.
- Jeremias, A., Davies, J.E., Maehara, A., et al. Blinded Physiological Assessment of Residual Ischemia After Successful Angiographic Percutaneous Coronary Intervention. JACC Cardiovasc Interv, 2019, 12 (20), 1991-2001.
- Agarwal, S.K., Kasula, S., Hacioglu, Y., Ahmed, Z., Uretsky, B.F., Hakeem, A. Utilizing Post-Intervention Fractional Flow Reserve to Optimize Acute Results and the Relationship to Long-Term Outcomes. JACC Cardiovasc Interv, 2016, 9 (10), 1022-1031.
- Lee, J.M., Choi, G., Koo, B.-K., et al. Identification of High-Risk Plaques Destined to Cause Acute Coronary Syndrome Using Coronary Computed Tomographic Angiography and Computational Fluid Dynamics. JACC Cardiovasc Imaging, 2018, doi:10.1016/j. jcmg.2018.01.023.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.