Inleiding
De behandeling van hartfalen met gedaalde linkerkamerejectiefractie (LVEF) heeft een enorme vlucht genomen en dit zowel dankzij een weliswaar complexe polyfarmacie (o.a. ACE-inhibitoren of angiotensinereceptorblokkers, bètablokkers, spironolacton, procoralan …) die de infauste prognose sterk verbeteren, middels finetuning van diuretica en door de toepassing van defibrillatoren en cardiale resynchronisatietherapie. Voor de patiënten met hartfalen met normale LVEF bestaat nog geen evidencebased behandeling. In de richtlijnen van de ESC1 wordt het belang onderstreept van comorbiditeiten, zoals nierinsufficiëntie, chronisch obstructief longlijden, anemie en de complexe interactie van deze comorbiditeiten met hartfalen. Het beschikbaar worden van analogen van erythropoiëtine heeft dan weer de aandacht getrokken naar het specifieke probleem van anemie.
Dit artikel geeft een bondig overzicht over de mogelijkheden van intraveneuze ijzertherapie als behandelingsmodaliteit bij patiënten met hartfalen.
Anemie en ijzertekort bij hartfalen
Volgens de WGO is er sprake van anemie als de hemoglobine lager is dan 12 g% bij de volwassen vrouw en lager dan 13 g% bij de volwassen man. In een conservatieve schatting komt anemie voor bij 22 tot 37 % van de patiënten met chronisch hartfalen.2 In een metaanalyse van ruim 150 000 patiënten bleek bovendien dat de mortaliteit op 6 maanden verdubbelde bij patiënten met hartfalen en anemie en dit zowel bij patiënten met gedaalde als bij patiënten met bewaarde LVEF.3
Naast anemie is ook ijzertekort met of zonder anemie een frequent voorkomende comorbiditeit bij patiënten met hartfalen. Sinds de FAIR-Hf-trial4 is de definitie van ijzertekort die door de ESC wordt aanvaard een ferritinegehalte van minder dan 100 μg/l of tussen 100 en 299 μg/l als de transferrinesaturatie lager is dan 20 %. Met deze definitie bleek in een internationale cohortestudie niet minder dan 50 % van de chronische hartfalenpatiënten (grotendeels met een gedaalde LVEF) een ijzertekort te hebben.5 In een grote groep patiënten die opgenomen werden met acuut gedecompenseerd hartfalen was de prevalentie nog hoger, nl. 69 % bij mannen en 75 % bij vrouwen.6 De groep bestond hoofdzakelijk uit patiënten met hartfalen met gedaalde LVEF maar er bleek in de prevalentie van ijzertekort geen verschil afhankelijk van de LVEF. IJzertekort komt bovendien meer voor bij ernstigere vormen (hogere NYHA-klasses) en gaat in een multivariate analyse gepaard met een 40 % hogere mortaliteit.4
Hoe is deze hogere mortaliteit te verklaren wanneer er bij hartfalen ook anemie en/of ijzertekort aanwezig is? De redenen waarom anemie een nadelige rol kan spelen bij patiënten met hartfalen liggen voor de hand. De zuurstoftoevoer naar de weefsels beantwoordt immers aan een metabole behoefte en is gelijk aan het product van het hartdebiet en de hoeveelheid zuurstof beschikbaar in het arteriële bloed. De hoeveelheid zuurstof in het arteriële bloed is rechtstreeks evenredig met het hemoglobinegehalte. Bij gezonde personen zonder hartfalen wordt een anemie vrij goed verdragen omdat er een grote marge is op zowel het hartdebiet als de perifere zuurstofextractie, die beide sterk kunnen toenemen. De zuurstofextractie bedraagt in rust ongeveer 25 % van de aangeboden zuurstof, m.a.w. de gemengd veneuze saturatie is ongeveer 75 %. Wanneer de zuurstofaanvoer afneemt, kan de zuurstofextractie probleemloos toenemen tot 60 %. Bij patiënten met hartfalen zonder anemie kan het zuurstofaanbod al verlaagd zijn door een te laag hartdebiet, waardoor de zuurstofextractie met een normaal hemoglobinegehalte al hoger is (de gemengd veneuze saturatie daalt). Wanneer er maximaal zuurstof geëxtraheerd wordt, kan alleen nog een toename van het hartdebiet de zuurstofbehoefte in evenwicht houden, wat extra belastend is voor het falende hart.7
Dat ijzerdeficiëntie ook zonder anemie de fysiopathologie en de prognose van patiënten met hartfalen nadelig kan beïnvloeden, ligt op het eerste gezicht dan weer minder voor de hand. Immers brengen we ijzer meestal bijna uitsluitend in verband met erytropoëse. IJzer is evenwel ook een essentiële cofactor voor een reeks proteïnen die een rol spelen in de stockage van zuurstof in de weefsels (als een bouwsteen van myoglobine) en productie van cellulaire energie (als onderdeel van oxidatieve enzymen en eiwitten van de ademhalingsketen in de mitochondriën) en dit zowel in skeletspierweefsel als in het myocard.8
IJzerhomeostase
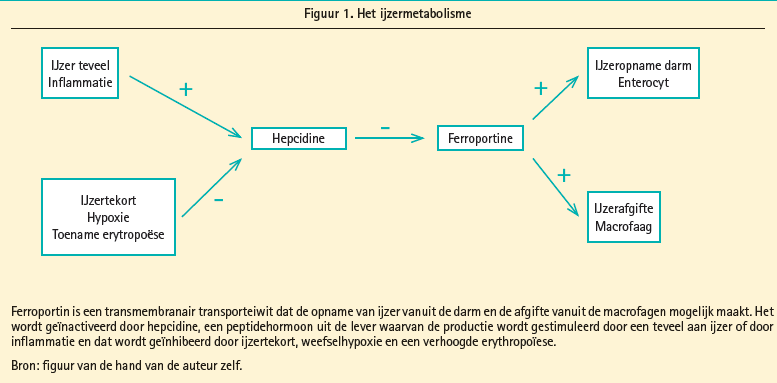
Het ijzermetabolisme (figuur 1) is complex en een mooi overzicht voor de clinicus wordt gegeven door Camaschella C.9 De ijzerabsorptie vanuit de darm is beperkt tot 1-2 mg per dag en het grootste deel van de ijzerbehoefte (ongeveer 25 mg per dag) van het lichaam wordt gedekt door recyclage van ijzer uit afbraak van erythrocyten door de macrofagen. De macrofagen spelen dus naast de enterocyten die de absorptie uit de darm voor hun rekening nemen, een sleutelrol in het ijzermetabolisme. Dat het ijzer grotendeels gerecycleerd wordt en het lichaam zich beschermt tegen een overload aan ijzer door de absorptie te beperken verklaart ook waarom men het onderscheid maakt tussen totaal en functioneel ijzertekort. In het eerste geval is de totale hoeveelheid ijzer in het lichaam te laag omdat de aanvoer te laag is of het verlies te hoog. In het tweede geval is de hoeveelheid ijzer in het lichaam normaal, maar het ijzer is niet of onvoldoende beschikbaar voor de erytropoëse en/of de andere metabole functies van het ijzer. De ijzerhomeostase in het lichaam wordt geregeld door het in de hepatocyt geproduceerde peptidehormoon, hepcidine. Hepcidine bindt zich aan ferroportin en inactiveert het. Ferroportin speelt een sleutelrol in de opname van ijzer vanuit de darm en in de afgifte van ijzer vanuit de macrofagen. Eenteveel aanijzer,maarookinflammatie doen de hepcidineconcentratie stijgen waardoor ferroportine wordt geïnactiveerd en zowel de absorptie uit de darm als de afgifte van ijzer vanuit de macrofagen naar het plasma wordt afgeremd. Afname van de hoeveelheid ijzer dan weer, alsook weefselhypoxie en een verhoogde nood aan erytropoëse remmen de hepcidineproductie af zodat de activiteit van ferroportin toeneemt en er méér ijzer vrijkomt uit de darm en de macrofagen. Bij functioneel ijzertekort, zoals bij inflammatoire aandoeningen maar ook bij hartfalen is de totale hoeveelheid ijzer in het lichaam normaal maar de hoge hepcidinespiegels beletten dat het ijzer beschikbaar is voor de erytropoëse en de andere functies van het ijzer.
Er zijn tal van redenen waarompatiënten met hartfalen een absoluut en/of functioneel ijzergebrek zouden ontwikkelen zoals het gebruik van protonpompinhibitoren en darmwandoedeem die de ijzerabsorptie verminderen, het gebruik van plaatjesremmers en/of anticoagulantia die occult bloedverlies veroorzaken in de darm, vrijzetten van pro-inflammatoire cytokines zoals interleukine-6 die de hepcidineconcentratie verhogen. Voor een goed overzicht zieMcDonagh, T. en Macdougall, I.8
Perorale of intraveneuze ijzerbehandeling?
Dat het lichaam zich zo goed beschermt tegen een teveel aan ijzer heeft ook tot gevolg dat het niet zo evident is om met perorale ijzerpreparaten de tekorten in het lichaam te herstellen. Perorale ijzertherapie kampt bovendien met tolerantieproblemen en dus met therapietrouw. Bovendien is het onmogelijk om met peroraal ijzer de reserves snél bij te vullen of zelfs op peil te houden, zeker wanneer het verlies aan ijzer groter is dan de beperkte opnamecapaciteit van het gastro-intestinaal stelsel toelaat. De beschikbaarheid van intraveneus toegediend ijzer laat toe op een snelle en efficiënte manier de ijzervoorraad te herstellen en omzeilt tevens het feit dat bij functioneel ijzertekort hoge hepcidinespiegels beletten dat het in het lichaam aanwezige ijzer beschikbaar is. Intraveneuze ijzerpreparaten werden evenwel tot voor kort ontraden vanwege het risico op anafylaxie, een zeldzame maar ernstige bijwerking. Bij de meest recente vorm van intraveneus ijzer, het ijzercarboxymaltose werden geen anafylactische reacties waargenomen. Rechtstreekse vergelijkingen tussen perorale en intraveneuze toediening van ijzer bij patiënten met hartfalen zijn niet beschikbaar. De enige studie bij hartfalenpatiënten met anemie aan wie peroraal ijzer systematisch werd toegediend betrof patiënten die niet aan de recente ESC-criteria voor ijzertekort voldeden.10 De perorale ijzertherapie had geen invloed op ferritine, transferrinesaturatie of hemoglobine na 27 weken. Bij chronische nierinsufficiëntie bleek intraveneuze ijzercarboxymaltose veel efficiënter dan peroraal ijzersulfaat in de correctie van ijzerdepletie en anemie.11 Men stelt dus vast dat voor het aanvullen van de ijzerreserves intraveneus ijzer veel effectiever is dan peroraal ijzer.
Voordelen van intraveneus ijzer bij patiënten met hartfalen en ijzertekort
De richtlijnen van de ESC voor diagnose en behandeling van chronisch hartfalen stellen dat 'ijzertekort een belangrijke comorbiditeit is bij hartfalen en dat ijzerdeficiëntie spierdisfunctie kan veroorzaken evenals anemie'.1 En verder: 'Intraveneuze (IV) ijzertherapie verbeterde de zelf gerapporteerde levenskwaliteit, de zesminutenwandeltest en de NYHA-klasse en kan dus worden overwogen als een behandelingsmodaliteit voor patiënten met hartfalen en ijzertekort ongeacht de aanwezigheid van anemie.'
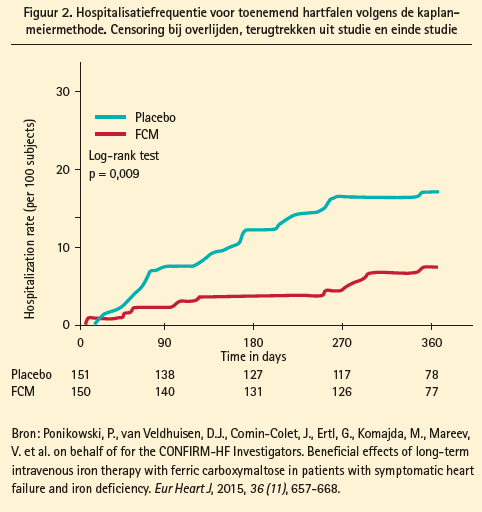
Deze aanbevelingen zijn gebaseerd in hoofdzaak op twee dubbelblinde placebogecontroleerde trials, nl. de FAIR-HF trial die liep over 6 maanden en de CONFIRM-HF trial over 12 maanden (figuur 2). In de FAIR-HF trial4 werden 459 patiënten met een LVEF lager dan 40 % (NYHA-klasse 2) of lager dan 45 % (NYHA-klasse 3) met ijzertekort volgens de hoger vermelde definitie gerandomiseerd tussen placebo en IV ijzercarboxymaltose. De met IV-ijzer behandelde groep deed het significant beter op het vlak van NYHA-klasse, levenskwaliteit, 6 minutenwandeltest, en dit ongeacht de aanwezigheid van anemie. In de subgroep met ijzertekort en anemie was er bovendien een significante toename van glomerulaire filtratiesnelheid. De CONFIRM-trial bevestigde deze resultaten maarmet hogere IV-dosis (1000 mg) en voor een duur van 12 maanden12 en toonde bovendien aan dat de IV-ijzertherapie het risico op hospitalisatie voor HF met 60 % deed dalen (HR 0,39, CI 0,19-0,82).
Hoewel het aan studies ontbreekt met harde eindpunten, zoals mortaliteit, staat het dus wel vast dat IV-ijzertherapie bij patiënten met hartfalen, gedaalde LVEF en ijzergebrek onmiskenbaar een aantal voordelen biedt, en dit ongeacht de aanwezigheid van anemie. Harde gegevens voor de behandeling van patiënten met hartfalen en normale LVEF zijn nog niet voorhanden maar er zijn daaromtrent enkele studies lopende.
Daarnaast blijkt IV-ijzertherapie in de praktijk bij geselecteerde patiënten met complexe hartfalenproblemen duidelijk een meerwaarde te bieden. Soms is die meerwaarde evident en voor de hand liggend, zoals bij de patiënt in de eerste kader, met moeilijk controleerbaar microscopisch gastro-intestinaal bloedverlies, ernstige anemie met hoge transfusienood en recidiverend ernstig corfalen, overigens met normale LVEF (pericarditis constrictiva). Soms is dit veel minder evident zoals bij de patiënt in de tweede kader, zonder anemie maar met een ernstig cardiorenaal dilemma en hartfalen klasse IV.

Referenties
- McMurray, J.J., Adamopoulos, S., Anker, S.D., Auricchio, A., Böhm, M., Dickstein, K. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Eur Heart J Fail, 2012, 14, 803-869.
- Van Veldhuisen, D.J., Anker, S.D., Ponikowski, P., Macdougall, I.C. Anemia and iron deficiency in heart failure: mechanisms and therapeutic approaches. Nat Rev Cardiol, 2011, 8 (9), 485-493.
- Groenveld, H., Januzzi, J.L., Damman, K., van Wijngaarden, J., Hillege, H.L., van Veldhuisen, D.J. et al. Anemia and mortality in heart failure patients: a systematic review and meta-analysis. J Am Coll Cardiol, 2008, 52, 818-827.
- Anker, D.S., Comin Colet, J., Filippatos, G., Willenheimer, R., Dickstein, K., Drexler, H. et al. FAIR-HF Trial Investigators. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency. N Engl J Med, 2009, 361, 2436-2448.
- Klip, I.T., Comin-Colet, J., Voors, A.A., Ponikowski, P., Enjuanes, C., Banasiak, W. et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J, 2013, 165, 575-582.
- Cohen-Solal, A., Damy, T., Terbah, M., Kerebel, S., Baguet, J.P., Hanon, O. et al. High prevalence of iron deficiency in patients with acute decompensated heart failure. Eur J Heart Fail, 2014, 16 (9), 984-991.
- Rosen, I.M., Maneker, S. Oxygen delivery and consumption. UpToDate [website], 2015.
- McDonagh, T.,Macdougall, I.C. Iron therapy for the treatment off iron deficiency in chronic heart failure: intravenous or oral? Eur Hear J Fail, 2015, 17 (3), 248-262.
- Camaschella, C. Iron-deficiency anemia. N Engl J Med, 2015, 372, 1832-1843.
- Ghali, J.K., Anand, I.S., Abraham, W.T., Fonarow, G.C., Greenberg, B., Krum, H. et al. Study of Anemia in Heart Failure Trial (STAMINA-HeFT) Group. Randomized double-blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia. Circulation, 2008, 117 (4), 526-535.
- Qunibi,W.Y., Martinez, C., Smith, M., Benjamin, J.,Mangione, A., Roger, S.D. A randomized controlled trial comparing intravenous ferric carboxymaltose with oral ironfor treatment of iron deficiency anemia of non-dialysis-dependent chronic kidney disease patients. Nephrol Dial Transplant, 2011, 26, 1599-1607.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J., Ertl, G., Komajda, M., Mareev, V. et al. on behalf of for the CONFIRM-HF Investigators. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J, 2015, 36 (11), 657-668.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.