Introduction
Le traitement de l'insuffisance cardiaque associée à une fraction d'éjection du ventricule gauche (FEVG) abaissée a connu un énorme essor, et ce, tant grâce à une polypharmacie certes complexe (notamment inhibiteurs de l'ECA ou antagonistes des récepteurs de l'angiotensine, bêta-bloquants, spironolactone, procoralan …), qui améliore fortement le pronostic défavorable, que via un ajustement des diurétiques et l'utilisation de défibrillateurs et la mise en oeuvre d'un traitement de resynchronisation cardiaque. Pour les patients atteints d'insuffisance cardiaque avec une FEVG normale, il n'existe pas encore de traitement fondé sur des données factuelles. Les lignes directrices de l'ESC1 soulignent l'importance des comorbidités telles qu'une insuffisance rénale, une bronchopneumopathie chronique obstructive, une anémie, et l'interaction complexe de ces comorbidités avec l'insuffisance cardiaque. La mise à disposition d'analogues de l'érythropoïétine a de son côté attiré l'attention sur le problème spécifique de l'anémie. Dans cet article, nous donnons un bref aperçu des possibilités du traitement martial intraveineux en tant que modalité thérapeutique chez les patients souffrant d'insuffisance cardiaque.
Anémie et déficit en fer dans l'insuffisance cardiaque
Selon l'OMS, on parle d'anémie lorsque le taux d'hémoglobine est inférieur à 12 g% chez la femme adulte et inférieur à 13 g% chez l'homme adulte. Selon une évaluation conservative, l'anémie se présente chez 22 à 37 % des patients souffrant d'insuffisance cardiaque chronique.2 Une méta-analyse portant sur plus de 150 000 patients a en outre montré que la mortalité à 6 mois a doublé chez les malades souffrant d'insuffisance cardiaque et d'anémie, et ce, aussi bien chez les patients présentant une FEVG abaissée que conservée.3
Outre l'anémie, la carence martiale avec ou sans anémie constitue également une comorbidité fréquente chez les insuffisants cardiaques. Depuis l'étude FAIR-Hf,4 la définition du déficit en fer acceptée par l'ESC est un taux de ferritine inférieur à 100 μg/l ou situé entre 100 et 299 μg/l si la saturation de la transferrine est inférieure à 20 %. Avec cette définition, il s'est avéré dans une étude de cohorte internationale que pas moins de 50 % des patients souffrant d'insuffisance cardiaque chronique (en grande partie avec une FEVG abaissée) présentent un déficit en fer.5 Dans un grand groupe de patients hospitalisés avec une insuffisance cardiaque aiguë décompensée, la prévalence était encore plus élevée, à savoir 69 % chez les hommes et 75 % chez les femmes.6 Le groupe se composait essentiellement de patients souffrant d'insuffisance cardiaque avec une FEVG abaissée, mais aucune différence de la prévalence de la carence martiale en fonction de la FEVG n'a été constatée. Le déficit en fer se rencontre en outre davantage dans les formes plus graves (classes NYHA plus élevées) et est associé à une mortalité de 40 % plus élevée dans une analyse multivariée.4
Comment expliquer cette mortalité plus élevée lorsqu'une insuffisance cardiaque s'accompagne également d'anémie et/ou de déficit en fer? Les raisons pour lesquelles l'anémie peut jouer un rôle négatif chez les insuffisants cardiaques sont évidentes. L'apport d'oxygène aux tissus répond en effet à un besoin métabolique et est égal au produit du débit cardiaque et de la quantité d'oxygène disponible dans le sang artériel. La quantité d'oxygène dans le sang artériel est directement proportionnelle au taux d'hémoglobine. Chez les personnes en bonne santé ne souffrant pas d'insuffisance cardiaque, une anémie est assez bien supportée parce qu'il existe une grande marge tant en ce qui concerne le débit cardiaque que l'extraction périphérique de l'oxygène, qui peuvent tous deux augmenter fortement. Au repos, l'extraction de l'oxygène s'élève à environ 25 % de l'oxygène apporté, en d'autres termes, la saturation veineuse mixte atteint environ 75 %. Si l'apport d'oxygène diminue, l'extraction de l'oxygène peut augmenter sans problème jusqu'à 60 %. Chez les patients souffrant d'insuffisance cardiaque sans anémie, l'apport d'oxygène peut déjà être diminué par un débit cardiaque trop faible, ce qui a pour effet que l'extraction de l'oxygène avec un taux d'hémoglobine normal est déjà plus élevée (la saturation veineuse mixte baisse). Lorsque l'oxygène est extrait au maximum, seule une augmentation du débit cardiaque peut encore maintenir les besoins d'oxygène en équilibre, ce qui constitue une surcharge supplémentaire pour le coeur défaillant.7
Le fait que la carence martiale puisse, même sans anémie, influer négativement la physiopathologie et le pronostic des insuffisants cardiaques, n'est en revanche pas évident à première vue. En effet, nous mettons le plus souvent le fer quasi exclusivement en relation avec l'érythropoïèse. Le fer est pourtant également un cofacteur essentiel pour une série de protéines qui jouent un rôle dans le stockage de l'oxygène dans les tissus (en tant que composant de la myoglobine) et la production de l'énergie cellulaire (en tant qu'élément des enzymes et des protéines oxydatives de la chaîne respiratoire mitochondriale), et ce, aussi bien dans le tissu musculaire squelettique que dans le myocarde.8
Homéostasie du fer
Le métabolisme du fer (figure 1) est complexe et une belle vue d'ensemble pour le clinicien en est donnée par Camaschella C.9 L'absorption du fer par l'intestin est limitée à 1-2 mg par jour et la majeure partie des besoins en fer (environ 25 mg par jour) de l'organisme est couverte par le recyclage du fer provenant de la dégradation des érythrocytes par les macrophages. Ces derniers jouent donc un rôle clé dans le métabolisme du fer à côté des entérocytes qui se chargent de l'absorption intestinale. Le fait que le fer soit recyclé en grande partie et que l'organisme se protège contre une surcharge en fer en limitant l'absorption de celui-ci explique également pourquoi on fait la distinction entre le déficit en fer total et fonctionnel. Dans le premier cas, la quantité totale de fer dans l'organisme est trop basse parce que l'apport est trop faible ou la déperdition trop élevée. Dans le second cas, la quantité de fer dans l'organisme est normale, mais il n'est pas ou pas suffisamment disponible pour l'érythropoïèse et/ou ses autres fonctions métaboliques. L'homéostasie du fer dans l'organisme est réglée par l'hormone peptidique, hepcidine, produite dans l'hépatocyte. L'hepcidine se fixe à la ferroportine et inactive celle-ci. La ferroportine joue un rôle clé dans l'absorption du fer au niveau de l'intestin et sa libération par les macrophages. Un excès de fer, mais aussi une inflammation, font augmenter la concentration d'hepcidine, ce qui a pour effet d'inactiver la ferroportine et tant l'absorption de fer au niveau de l'intestin que sa libération dans le plasma par les macrophages sont inhibées. La diminution de la quantité de fer, ainsi que l'hypoxie tissulaire et un besoin accru d'érythropoïèse, inhibent la production d'hepcidine, de sorte que l'activité de la ferroportine augmente et qu'une plus grande quantité de fer est libérée par l'intestin et les macrophages. En cas de carence martiale fonctionnelle, comme dans les affections inflammatoires, mais aussi en cas d'insuffisance cardiaque, la quantité totale de fer dans l'organisme est normale, mais les taux élevés d'hepcidine empêchent que le fer soit disponible pour l'érythropoïèse et ses autres fonctions.
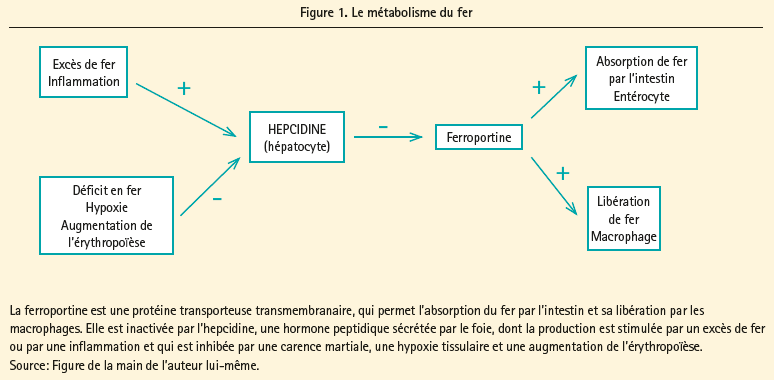
Il existe un grand nombre de raisons pour lesquelles les patients souffrant d'insuffisance cardiaque développent une carence martiale absolue et/ ou fonctionnelle, telles que l'utilisation d'inhibiteurs de la pompe à proton et un oedème de la paroi intestinale qui diminuent l'absorption du fer, l'utilisation d'antiagrégants plaquettaires et/ou d'anticoagulants qui provoquent une hémorragie occulte dans l'intestin, la libération de cytokines proinflammatoires telles que l'interleukine-6 qui augmentent la concentration d'hepcidine. Pour une bonne revue du sujet, voir McDonagh, T. et Macdougall, I.8
Traitement martial peroral ou intraveineux?
Le fait que l'organisme se protège si bien contre un excès de fer a également pour conséquence qu'il n'est pas si facile de corriger les carences de l'organisme avec des préparations perorales de fer. Le traitement martial per os est en outre associé à des problèmes de tolérance et donc d'observance thérapeutique. En outre, il est impossible de reconstituer rapidement les réserves ou même de les maintenir à niveau avec du fer peroral, a fortiori lorsque la déperdition de fer est plus importante que la capacité d'absorption limitée du système gastrointestinal ne le permet. La disponibilité du fer administré par voie intraveineuse permet de reconstituer la réserve de fer rapidement et efficacement et contourne également le fait qu'en cas de carence martiale fonctionnelle, les taux élevés d'hepcidine empêchent que le fer présent dans l'organisme soit disponible. Les préparations intraveineuses de fer étaient toutefois déconseillées jusqu'il y a peu en raison du risque d'anaphylaxie, un effet secondaire rare, mais grave. Avec la forme de fer intraveineux la plus récente la carboxymaltose ferrique, aucune réaction anaphylactique n'a été observée. On ne dispose pas de comparaisons directes entre l'administration perorale et intraveineuse de fer chez des patients souffrant d'insuffisance cardiaque. La seule étude chez des insuffisants cardiaques souffrant d'anémie auxquels du fer peroral avait été systématiquement administré concernait des malades qui ne répondaient pas aux critères du déficit en fer récemment publiés par l'ESC.10 Le traitement martial peroral n'avait pas eu d'influence sur la ferritine, la saturation de la transferrine ou l'hémoglobine après 27 semaines. En cas d'insuffisance rénale chronique, la carboxymaltose ferrique intraveineuse s'est avérée beaucoup plus efficace que le sulfate de fer peroral dans la correction de la carence martiale et de l'anémie.11 On constate donc que le fer intraveineux est beaucoup plus efficace que le fer peroral pour la reconstitution des réserves de fer.
Avantages de l'administration intraveineuse de fer chez des patients souffrant d'insuffisance cardiaque et de carence martiale
Les lignes directrices de l'ESC relatives au diagnostic et au traitement de l'insuffisance cardiaque chronique indiquent que la carence en fer est une importante comorbidité de l'insuffisance cardiaque et que le déficit en fer peut provoquer une dysfonction musculaire ainsi que de l'anémie.1 Et plus loin : que le traitement martial intraveineux (IV) a amélioré la qualité de vie auto-rapportée, les résultats du test de marche de six minutes et la classe NYHA et peut donc être considéré comme une modalité thérapeutique pour les patients souffrant d'insuffisance cardiaque et de déficit en fer, indépendamment de l'existence d'une anémie.
Ces recommandations sont essentiellement fondées sur deux études réalisées en double aveugle et contre placebo, à savoir l'étude FAIR-HF, qui s'est déroulée sur 6 mois et l'étude CONFIRM-HF sur 12 mois (figure 2). Dans l'étude FAIRHF, 4 459 patients présentant une FEVG inférieure à 40 % (classe NYHA 2) ou inférieure à 45 % (classe NYHA 3), affectés d'une carence martiale selon la définition mentionnée ci-dessus ont été assignés aléatoirement à un groupe sous placebo et à un groupe sous carboxymaltose ferrique IV. Le groupe sous traitement martial IV a enregistré des scores nettement meilleurs en termes de classe NYHA, de qualité de vie et de test de marche de 6 minutes, et ce, indépendamment de l'existence d'une anémie. Dans le sous-groupe atteint de carence martiale et d'anémie, on a observé en outre une augmentation significative de la vitesse de filtration glomérulaire. L'étude CONFIRM a confirmé ces résultats, mais avec une dose IV plus élevée (1 000 mg) et pour une durée de 12 mois (16), et a montré en outre que le traitement martial IV faisait baisser de 60 % le risque d'hospitalisation pour IC (RR 0,39, IC 0,19-0,82).
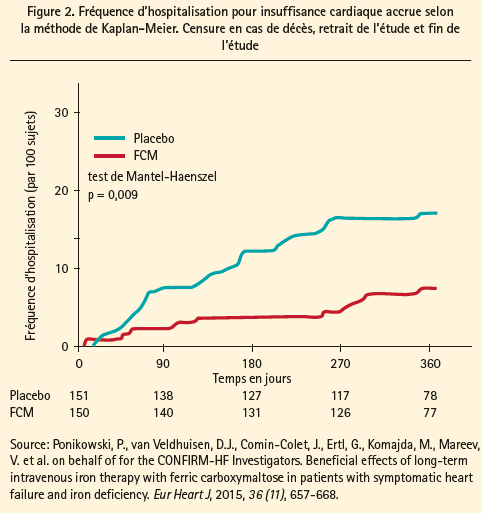
Bien que l'on ne dispose pas d'études avec des critères d'évaluation solides, tels que la mortalité, il est donc bien établi que le traitement martial IV chez les patients présentant une insuffisance cardiaque, une FEVG abaissée et un déficit en fer, offre indéniablement un certain nombre d'avantages, et ce, indépendamment de l'existence d'une anémie. On ne dispose pas encore de données solides pour le traitement des patients souffrant d'insuffisance cardiaque avec une FEVG normale, mais quelques études à cet égard sont en cours.
Il s'avère en outre que le traitement martial IV peut clairement offrir une plusvalue dans la pratique chez des patients sélectionnés présentant des problèmes d'insuffisance cardiaque complexes. Parfois, cette plus-value est évidente comme pour le patient dans le premier encadré, présentant une hémorragie gastro-intestinale microscopique difficilement maîtrisable, une anémie grave avec un besoin de transfusion élevé et une insuffisance cardiaque grave récidivante, avec pour le reste une FEVG normale (péricardite constrictive). Parfois, cette plus-value est beaucoup moins évidente, comme pour le patient dans le second encadré, sans anémie, mais avec un dilemme cardiorénal grave et une insuffisance cardiaque de classe IV.
Clinical case 1
Le premier patient est un homme âgé à présent de 86 ans avec des antécédents de pontage coronarien (1997), compliqué de pleuropéricardite (syndrome de Dressler), fibrillation auriculaire chronique persistante et un AIT (2004), hyperthyréose due à l'amiodarone, décompensation cardiaque récidivante sur la base d'une péricardite constrictive depuis 2010, anémie progressive récidivante à partir d'une hémorragie gastro-intestinale occulte, qui a fait l'objet d'investigations par gastro- et coloscopie, vidéo-capsule qui était négative, depuis 2010, admissions à répétition pour décompensation cardiaque et anémie (le plus souvent, Hgb < 7 g%, MCV très bas < 70 fl, en 2014, au total, transfusion de 8 unités de packed cells et environ tous les quatre mois, hospitalisation pour décompensation cardiaque massive sur la base d'une anémie et d'une péricardite constrictive, ayant nécessité des diurétiques de l'anse IV, une transfusion et l'administration IV de fer. Depuis, suivi par le médecin de famille avec réorientation sur la base du statut martial (dès que le taux de ferritine passe sous les 100 μg/l et/ou la saturation de transferrine en deçà de 20 %), parfaitement euvolumique (sous spironolactone 100 mg, bumétamide 5 mg par jour), NYHA 2 et hospitalisation de jour uniquement pour le traitement martial intraveineux sans transfusion, dernière hospitalisation de jour avec hémoglobine 12,6 g%, MCV 80 fl, fer 39 μg/dl, saturation de TF 10 %, ferritine 68 μg/l sans décompensation cardiaque, sans besoin de diurétiques de l'anse IV ou de transfusion, uniquement administration de 1 000 mg IV de carboxymaltose ferrique (10 minutes!).
Clinical case 2
Homme de 64 ans avec cardiomyopathie ischémique et dilemme cardiorénal grave, fibrillation auriculaire persistante sous anticoagulants (anti-vitamine K) et signes persistants de congestion avec anasarque.
Est vu le 22 avril 2016 avec classe fonctionnelle NYHA 3, poids de 62 kg, traitement d'entretien avec spironolactone 100 mg et bumétamide 5 mg. Résultats des analyses de laboratoire : Hgb 15,7 g%, MCV 89 fl, eGFR 21 ml/min, PROBNP 28324 pg/ml, ferritine 95 μg/lit, saturation de transferrine 12,7 %. Donc clairement carencé en fer selon les critères de l'ESC. Le traitement n'est pas modifié, uniquement administration en hôpital de jour de 1 000 mg de carboxymaltose ferrique.
Le 17 mai 2016, le poids du patient est descendu à 58 kg, l'oedème a disparu, Hgb 16,7 g% (hémoconcentration?), eGFR 25 ml/min, PROBNP 22658 pg/ml.
Nous voyons donc que la normalisation du statut martial a fait disparaître l'oedème, a considérablement amélioré la fonction rénale et a fait baisser le PROBNP. Le patient ne semble donc plus en hypervolémie et les diurétiques de l'anse sont progressivement diminués. Lors du contrôle du 7 juin 2016, son poids a encore diminué, le PROBNP a baissé jusqu'à 12365 pg/ml et la dose des diurétiques de l'anse peut encore être réduite.
Références
- McMurray, J.J., Adamopoulos, S., Anker, S.D., Auricchio, A., Böhm, M., Dickstein, K. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Eur Heart J Fail, 2012, 14, 803-869.
- Van Veldhuisen, D.J., Anker, S.D., Ponikowski, P., Macdougall, I.C. Anemia and iron deficiency in heart failure: mechanisms and therapeutic approaches. Nat Rev Cardiol, 2011, 8 (9), 485-493.
- Groenveld, H., Januzzi, J.L., Damman, K., van Wijngaarden, J., Hillege, H.L., van Veldhuisen, D.J. et al. Anemia and mortality in heart failure patients: a systematic review and meta-analysis. J Am Coll Cardiol, 2008, 52, 818-827.
- Anker, D.S., Comin Colet, J., Filippatos, G., Willenheimer, R., Dickstein, K., Drexler, H. et al. FAIR-HF Trial Investigators. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency. N Engl J Med, 2009, 361, 2436-2448.
- Klip, I.T., Comin-Colet, J., Voors, A.A., Ponikowski, P., Enjuanes, C., Banasiak, W. et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J, 2013, 165, 575-582.
- Cohen-Solal, A., Damy, T., Terbah, M., Kerebel, S., Baguet, J.P., Hanon, O. et al. High prevalence of iron deficiency in patients with acute decompensated heart failure. Eur J Heart Fail, 2014, 16 (9), 984-991.
- Rosen, I.M., Maneker, S. Oxygen delivery and consumption. UpToDate [website], 2015.
- McDonagh, T., Macdougall, I.C. Iron therapy for the treatment off iron deficiency in chronic heart failure: intravenous or oral? Eur Hear J Fail, 2015, 17 (3), 248-262.
- Camaschella, C. Iron-deficiency anemia. N Engl J Med, 2015, 372, 1832-1843.
- Ghali, J.K., Anand, I.S., Abraham, W.T., Fonarow, G.C., Greenberg, B., Krum, H. et al. Study of Anemia in Heart Failure Trial (STAMINA-HeFT) Group. Randomized double-blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia. Circulation, 2008, 117 (4), 526-535.
- Qunibi, W.Y., Martinez, C., Smith, M., Benjamin, J., Mangione, A., Roger, S.D. A randomized controlled trial comparing intravenous ferric carboxymaltose with oral ironfor treatment of iron deficiency anemia of non-dialysis-dependent chronic kidney disease patients. Nephrol Dial Transplant, 2011, 26, 1599- 1607.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J., Ertl, G., Komajda, M., Mareev, V. et al. on behalf of for the CONFIRM-HF Investigators. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J, 2015, 36 (11), 657-668.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.