Dit artikel is een verslag van de sessie over multimodality imaging op het BSC 2018 waarin prof. dr. Habib, dr. Bucciarelli en prof. dr. Van Camp het gebruik van multimodality imaging hebben besproken bij respectievelijk restrictieve cardiomyopathie, hypertrofe cardiomyopathie en ischemische cardiomyopathie. In deze sessie werd de nadruk gelegd op beeldvorming in het kader van de diagnostiek en het bepalen van de etiologie van de verschillende cardiomyopathie ën. Tot slot heeft dr. Claeys de resultaten besproken van zijn studie over de effecten van sildenafil op pulmonaal vasculaire weerstand en rechter ventriculaire contractiele reserve in chronisch trombo-emboligene ziekte (CTED).
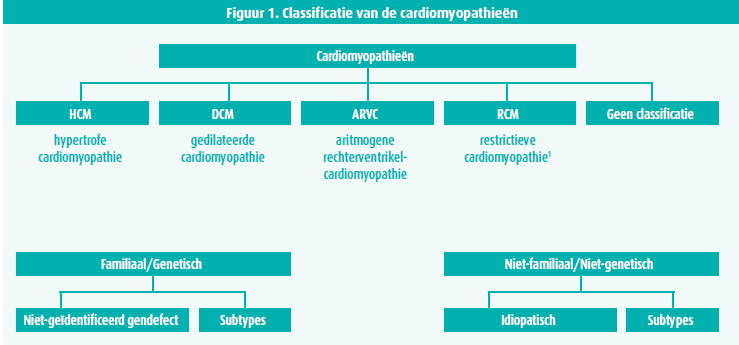
Een cardiomyopathie is een aandoening waarbij de hartspier structureel en functioneel abnormaal is, in de afwezigheid van coronairlijden, hypertensie, kleplijden of congenitale ziekte. Cardiomyopathie ën worden verdeeld in verschillende groepen afhankelijk van hun morfologie en functioneel fenotype, en onderverdeeld in familiale en niet-familiale vormen (figuur 1).1
Restrictieve cardiomyopathie
Restrictieve cardiomyopathie ën (RCM) worden gekarakteriseerd door een restrictieve ventriculaire fysiologie (het stijgen van ventriculaire vullingsdrukken door toegenomen stijfheid van het myocard) in aanwezigheid van normale of verminderde diastolische volumes (van een of beide ventrikels), normale of verminderde systolische volumes en een normale ventriculaire wanddikte. RCM 's zijn een diverse groep van myocardiale ziektes met een breed spectrum aan etiologie ën, zowel familiaal, genetisch als verworven. Verschillende beeldvormingstechnieken spelen een belangrijke rol bij de diagnose, prognose en behandeling van de RCM 's.1
Echocardiografie toont typisch een diastolische disfunctie en vergrote atria (ge ïndexeerd linker atriaal volume > 50 ml/m2). Het mitralisinflowsignaal toont een restrictief vullingspatroon met een E/A-ratio ≥ 2.0, een korte deceleratietijd ≤ 150 ms en een isovolumetrische relaxatietijd van ≤ 60-70 ms. Pulmonale veneuze flow toont S < D, A velocity > 35 cm/s en Ap-Am > 30 ms. Tissue Doppler Imaging (TDI) toont verminderde septale en laterale e '-snelheden < 3-4 cm/s en een E/E '-ratio > 14.
Cardiale MRI (CMR) kan gebruikt worden voor weefseltypering (T1 voor vet, T2 voor oedeem, T2* voor ijzerdepositie) en het accuraat meten van volumina en functie. De verschillende patronen van Late Gadolinium Enhancement (LGE) helpen tevens bij de differentiaaldiagnose van RCM 's (zie onder).
Ook cardiale CT (anatomie, pericard en extracardiale bevindingen), nucleaire beeldvorming (amylo ïdose en sarco ïdose) en myocardbiopten kunnen de diagnose van bepaalde types RCM vergemakkelijken.
Enkele voorbeelden van subtypes van restrictieve cardiomyopathie ën met hun typische afwijkingen bij de verschillende beeldvormingstechnieken zijn:
- Idiopathische RCM 's. Echocardiografie toont morfologisch gedilateerde atria en niet-hypertrofe, niet-gedilateerde ventrikels met een normale linkerventrikel (LV) systolische functie. Het vullingspatroon bij Doppler imaging is restrictief. Tissue Doppler Imaging (TDI) helpt bij het graderen van diastolische functie en bij de differentiaaldiagnose met pericarditis constrictiva (RCM E ' < 8 cm/s, E/E ' > 15, pericarditis constrictiva E ' > 8 cm/s, E/E ' < 15).
- Amylo ïdose. Echocardiografie toont hypertrofie van het niet-gedilateerde LV en het interatriale septum met een gespikkeld aspect van het myocardium, verdikte kleppen en gedilateerde atria. 2D-strainanalyse vertoont gestoorde systolische strainparameters (voornamelijk longitudinale strain) met relatief gespaarde apex (voorkeur van amylo ïddepositie in de basale segmenten). Circumferentieel subendocardiale aankleuring of midmyocardiale aankleuring (zebrapatroon) is zichtbaar op MRI-beelden.2 Scintigrafie kan amylo ïdose diagnosticeren en differenti ëren tussen de verschillende subtypes (zeer hoge sensitiviteit (97 %) en specificiteit (100 %) van scintigrafie voor TTR-vorm van amylo ïdose).3
- Ziekte van Fabry. Echocardiografie toont een concentrische niet-obstructieve hypertrofie in afwezigheid van arteri ële hypertensie. Gedaalde snelheden worden gezien bij Tissue Doppler Imaging. LGE-beelden op MRI tonen voornamelijk aankleuring van de inferolaterale mid- en basale segmenten.
- Chemotoxiciteit. Echocardiografie toont excentrische LV-remodelling met dilatatie, verdunnen van de wand, gestoorde restrictieve diastolische functie en uiteindelijk tevens achteruitgang van de systolische functie.4 Globale longitudinale strain (GLS) is een goede parameter voor vroegtijdige detectie van subklinische LV-disfunctie (dalen GLS > 15 % t.o.v. baseline).
- Endomyocardiale fibrose. Echocardiografie toont apicale obliteratie van linker- en/of rechterventrikel, endocardverdikking en een restrictief vullingspatroon. CMR met LGE is de gouden standaard voor diagnose van endomyocardiale fibrose en toont aankleuring van het endocard, voornamelijk ter hoogte van de apex en de inflow tracts van beide ventrikels. Het typisch V-teken ter hoogte van de LV-apex toont een 3-lagig myocard, verdikt fibrotisch endomyocard en aanliggende trombus.6
Zoals hierboven aangetoond is multimodality imaging belangrijk voor het bepalen van de diagnose en prognose van een RCM. Daarnaast zijn bijkomende onderzoeken zoals endomyocardbiopsie, familiale screening en genetische studies frequent noodzakelijk.
Hypertrofe cardiomyopathie
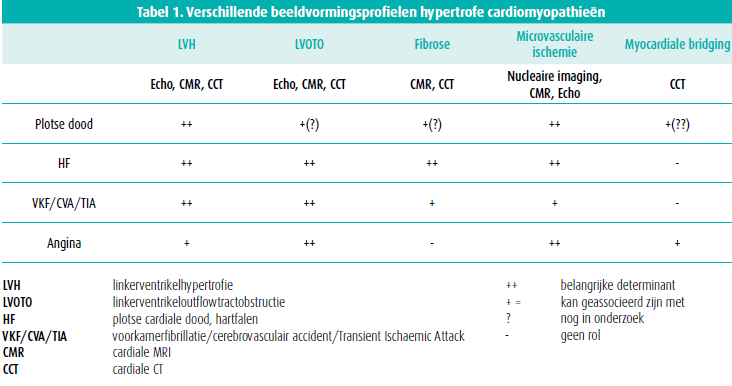
Hypertrofe cardiomyopathie (HCM) is een majeure oorzaak van onverklaarde LV-hypertrofie (LVH), wat ook effect heeft op andere cardiale structuren zoals het mitralisklepapparaat, de coronairen en het cardiale interstitium. HCM is meestal een benigne aandoening, maar kan ook leiden tot plotse dood, hartfalen, voorkamerfibrillatie en myocardiale ischemie. Multimodality-imagingtechnieken (echocardiografie, cardiale MR, cardiale CT en nucleaire beeldvorming) kunnen helpen bij de diagnose en klinische behandeling van de verschillende klinische profielen van HCM (tabel 1). Meer dan 50 % van de pati ënten heeft afwijkingen ter hoogte van het mitralisklepapparaat (> 25 % heeft afwijkingen van de chordae), 33 % van de pati ënten heeft linkerventrikeloutflowtract (LVOT) obstructie (piekgradi ënt > 30 mmHg in rust of bij uitlokkende (valsalva)maneuvers).
Echocardiografie moet jaarlijks of tweejaarlijks uitgevoerd worden bij stabiele pati ënten, een CMR minstens é én keer na de diagnose van HCM. Echocardiografie wordt gebruikt in eerste lijn, maar kan aangevuld worden met CMR bij twijfelachtige data, suboptimale echobeelden, abnormale ecg 's met normale echobeelden en bij families met een niet-diagnostische echocardiografie.
Echocardiografie geeft informatie over de wanddikte (> 15 mm, > 13 mm bij eerstegraadsverwanten), aanwezigheid van asymmetrische septale hypertrofie of rechterventrikelhypertrofie, grootte van de linkventrikelcaviteit, systolische en diastolische functie, de aanwezigheid van LVOT-obstructie en Systolic Anterior Movement (SAM). Metingen moeten zorgvuldig gebeuren: einddiastolisch en op verschillende niveaus op korte as, zo nodig met gebruik van contrast.
Cardiale MR is beter voor het bepalen van de LVH (volume, massa), de distributie van de hypertrofie (al dan niet asymmetrisch, al dan niet apicaal), de aanwezigheid van LVOT of midcavitaire obstructie en de betrokkenheid van het mitralisklepapparaat. De graad en distributie van fibrose met LGE helpt bij de differentiaaldiagnose van HCM: aankleuring bij HCM is voornamelijk ter hoogte van de rechterventrikelinsertiepunten en intramuraal. Daarnaast is de hoeveelheid fibrose een uiting van progressie van de ziekte en aldus een predictor voor aritmie.8 De suggestie werd geopperd om dit in de toekomst eventueel toe te voegen aan de plotsedoodcalculator bij HCM van de Europese Vereniging voor Cardiologie (http://www.doc2do.com/ hcm/webHCM.html).
Ischemische cardiomyopathie
Tijdens de sessie over multimodality imaging bij ischemische cardiomyopathie (ICM) werd de nadruk gelegd op beeldvorming voor het detecteren van ischemie bij stabiel coronairlijden. Standaard moeten bij pati ënten met klachten verdacht voor stabiel coronairlijden een rustecg, een bloedafname, een rustechocardiografie en eventueel een holter gebeuren. Daarnaast moet een driestappenplan gevolgd worden:
Eerst moet de pretestprobabiliteit (PTP) bepaald worden. Bij een lage PTP (< 15 %) en een hoge (> 85 %) PTP heeft een niet-invasieve (stress)test weinig zin omdat de kans op stabiel coronairlijden respectievelijk laag en hoog blijft, onafhankelijk van het resultaat van de test. Vervolgens kan de diagnose van stabiel coronairlijden gesteld worden met behulp van (een combinatie van) niet-invasieve testen (coronaire CT, ergometrie en stress imaging met echocardiografie, CMR, SPECT of PET) bij pati ënten met intermediaire PTP van 15-85 %. Tot slot is het belangrijk om het risico op een event in te schatten om te bepalen of revascularisatie moet gebeuren (indien hoog risico op een event met mortaliteit ≥ 3 %/jaar of eventueel bij intermediair risico 1-3 %/jaar).9 Optimale medicamenteuze therapie blijft immers de hoeksteen van de behandeling aangezien de COURAGE- trial toonde dat pati ënten met bewezen ischemie die gestent werden geen verbeterde overleving hebben tegenover pati ënten die optimale medicamenteuze therapie kregen.10, 11 Invasieve meting van Fractional Flow Reserve (FFR) met een waarde < 0,80 past bij een stenose die ischemie kan veroorzaken tijdens inspanning en dus het best gerevasculariseerd wordt (betere outcome bij revascularisatie). Pati ënten met afwijkende niet-invasieve ischemietesten hebben echter vaak een normale FFR. De DEFER- en FAME-I-studies hebben aangetoond dat het veiliger is om niet te revasculariseren als de FFR negatief is.12, 13 Cardiale CT in combinatie met FFR lijkt beloftevol voor de toekomst en moet vergeleken worden met standaard niet-invasieve ischemietesten in gerandomiseerde trials.9
Als laatste topic van de sessie over multimodality imaging stelde dr. Claeys (UZ Leuven) zijn onderzoek voor over het effect van sildenafil bij pati ënten met chronisch trombo-emboligene ziekte (CTED). Pati ënten met CTED hebben een verminderde inspanningscapaciteit ondanks afwezigheid van pulmonale hypertensie in rust. Stress testing kan milde ziekte aantonen (gestoorde pulmonaal-vasculaire weerstand met P/Q-slope > 3 mmHg.L-1.min en een gestoorde contractiele reserve van het rechterventrikel). Sildenafil kan de inspanningscapaciteit verbeteren door het verminderen van rechterventrikelafterload, proportioneel aan de ziekte-ernst.
Multimodality imaging is belangrijk voor het bepalen van de diagnose, de differentiaaldiagnose en de prognose van de verschillende cardiomyopathie ën. Er moeten nog verdere studies gebeuren om aan te tonen welke combinatie van beeldvormingstechnieken het best gebruikt wordt voor elke vorm van cardiomyopathie. LGE op CMR (en dus fibrose) kan in de toekomst misschien ge ïntegreerd worden in de plotsedoodcalculator bij HCM. Ischemie bij ICM kan gedetecteerd worden door niet-invasieve stresstesten, maar voorlopig zijn er geen studies die aantonen dat mensen die op basis van deze testen gerevasculariseerd worden een betere outcome hebben dan mensen onder optimale medicamenteuze therapie. Invasieve FFR heeft wel bewezen dat revascularisatie een betere outcome geeft. Daarom lijkt CT met FFR beloftevol voor de toekomst, maar verdere studies zijn lopende.
Referenties
- Elliott, P., Andersson, B., Arbustini, E. et al. Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur Heart J, 2007, 29, 270-276. doi:10.1093/eurheartj/ ehm342.
- Habib, G., Bucciarelli-Ducci, C., Caforio, A.L.P. et al. Multimodality imaging in restrictive cardiomyopathies: an EACVI expert consensus document. Eur Heart J - Cardiovasc Imaging, 2017, 18, 1090-1121. doi:10.1093/ ehjci/jex034.
- Di Bella, G., Pizzino, F., Minutoli, F. et al. The mosaic of the cardiac amyloidosis diagnosis: role of imaging in subtypes and stages of the disease. Eur Heart J - Cardiovasc Imaging, 2014, 15, 1307-1315. doi:10.1093/ehjci/ jeu158.
- Habib, G., Bucciarelli-Ducci, C., Caforio, A.L.P. et al. Multimodality imaging in restrictive cardiomyopathies: an EACVI expert consensus document. Eur Heart J - Cardiovasc Imaging, 2017, 18, 1090-1121. doi:10.1093/ ehjci/jex034.
- Plana, J.C., Galderisi, M., Barac, A. et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr, 2014, 27, 911-939. doi:10.1016/j.echo.2014.07.012.
- Salemi, V.M.C., Rochitte, C.E., Shiozaki, A.A. et al. Late gadolinium enhancement magnetic resonance imaging in the diagnosis and prognosis of endomyocardial fibrosis patients. Circ Cardiovasc Imaging, 2011, 4, 304-311. doi:10.1161/CIRCIMAGING. 110.950675.
- Cardim, N., Galderisi, M., Edvardsen, T. et al. Role of multimodality cardiac imaging in the management of patients with hypertrophic cardiomyopathy: an expert consensus of the European Association of Cardiovascular Imaging Endorsed by the Saudi Heart Association. Eur Heart J - Cardiovasc Imaging, 2015, 16, 280-280. doi:10.1093/ehjci/jeu291.
- Cardim, N., Galderisi, M., Edvardsen, T. et al. Role of multimodality cardiac imaging in the management of patients with hypertrophic cardiomyopathy: an expert consensus of the European Association of Cardiovascular Imaging Endorsed by the Saudi Heart Association. Eur Heart J - Cardiovasc Imaging, 2015, 16, 280-280. doi:10.1093/ehjci/jeu291.
- Montalescot, G., Sechtem, U., Achenbach, S. et al. 2013 ESC guidelines on the management of stable coronary artery disease. Eur Heart J, 2013, 34, 2949-3003. doi:10.1093/eurheartj/eht296.
- Boden, W.E., O 'Rourke, R.A., Teo, K.K. et al. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med, 2007, 356, 1503-1506. doi:10.1056/NEJMoa070829.
- Shaw, L.J., Berman, D.S., Maron, D.J. et al. Optimal medical therapy with or without percutaneous coronary intervention to reduce ischemic burden: results from the Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation (COURAGE) trial nuclear substudy. Circulation, 2008, 117, 1283-1291. doi:10.1161/CIRCULATIONAHA.107.743963.
- Pijls, N.H.J., van Schaardenburgh, P., Manoharan, G. et al. Percutaneous Coronary Intervention of Functionally Nonsignificant Stenosis: 5-Year Follow-Up of the DEFER Study. J Am Coll Cardiol, 2007, 49, 2105-2111. doi:10.1016/J.JACC.2007.01.087.
- De Bruyne, B., Fearon, W.F., Pijls, N.H.J. et al. Fractional Flow Reserve -Guided PCI for Stable Coronary Artery Disease. N Engl J Med, 2014, 371, 1208-1217. doi:10.1056/NEJMoa1408758.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.