Inleiding
Takotsubocardiomyopathie, ook 'broken heart disease, myocardial stunning disease en stress-induced cardiomyopathy ' genoemd, is een acuut linkerhartfalen als gevolg van lichamelijke of emotionele stress dat wordt veroorzaakt door een catecholaminerge ontlading.1 Het syndroom dankt zijn naam aan de vorm van het linkerventrikel bij ventriculografie: het linkerventrikel lijkt op een tako tsubo, een vaas met brede basis en smalle hals, die Japanse vissers gebruiken om inktvissen te vangen (tako en tsubo zijn Japans voor inktvis en vaas). Een takotsubocardiomyopathie geeft een klinisch beeld van een acuut coronair syndroom met een compatibel ecg. Een echocardiografie toont meestal een brede akinesie van de apex van het linkerventrikel. Een coronariografie toont geen significante coronaire letsels en de hartenzymen zijn verhoogd, maar niet in verhouding tot de ernst van de myocarddisfunctie.1-2
Wij presenteren het geval van een pati ënte die een takotsubocardiomyopathie heeft ontwikkeld na een tonisch-klonische epilepsieaanval. Die associatie is zeldzaam, maar wordt sinds een tiental jaar toch steeds vaker gerapporteerd in de literatuur.3-6Dat zou een van de oorzaken kunnen zijn van SUDEP (Sudden Unexplained Death in Epilepsy). Daarom worden nu telemetrie en bepaling van het troponinegehalte aanbevolen bij vermoeden van een takotsubocardiomyopathie na een epilepsieaanval, ook als er geen voorgeschiedenis of klachten zijn.4, 7-8
Samenvatting van de klinische casus
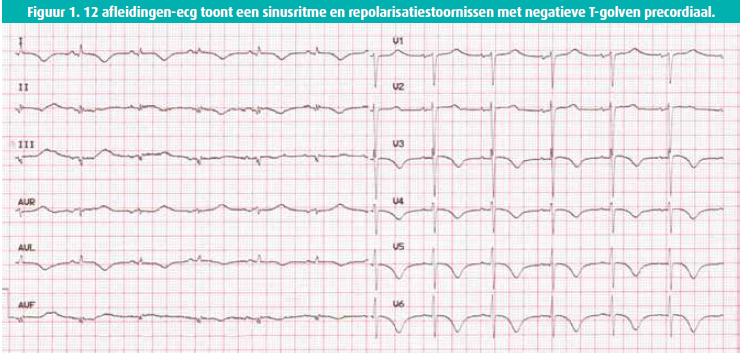
Een 63-jarige vrouw wordt door de mug naar het ziekenhuis gebracht wegens een tonisch-klonische aanval geobjectiveerd door haar dochter en opgetreden in het kader van een recente alcoholabstinentie. De pati ënte wordt teruggevonden in een postkritische toestand en komt geleidelijk weer bij bewustzijn bij aankomst van de mug, maar kort daarna krijgt ze weer een aanval. Ze wordt op de intensive care behandeld met clonidine en diazepam, waarmee haar toestand gestabiliseerd wordt. Een CT-scan sluit een hersenbloeding uit. Tijdens het ziekenhuisverblijf (+ 36 uur) krijgt ze geen epilepsieaanval meer, maar verschijnen er repolarisatiestoornissen bij hartmonitoring. Het 12 afleidingenelektrocardiogram (ecg) toont diffuse repolarisatiestoornissen anterolateraal (negatieve T-golven) (figuur 1). Het troponinegehalte is verhoogd: 163 pg/ ml (normaal < 14 pg/ml). De pati ënte heeft geen pijn of andere klachten. Ze is chronisch alcoholverslaafd. Ze probeert af en toe te stoppen met drinken. Het alcoholisme is gecompliceerd met een polyneuropathie, hypertensie, een type 2-diabetes waarvoor geen insuline vereist is en een ongecompliceerde atheromatose van de onderste ledematen. Ze neemt de volgende medicatie in: bisoprolol 5 mg, pregabaline 150 mg, escitalopram 10 mg, metformine 850 mg, atorvastatine 40 mg en spironolacton/altizide 25 mg/15 mg. Er is geen persoonlijke of familiaire voorgeschiedenis van coronairlijden.
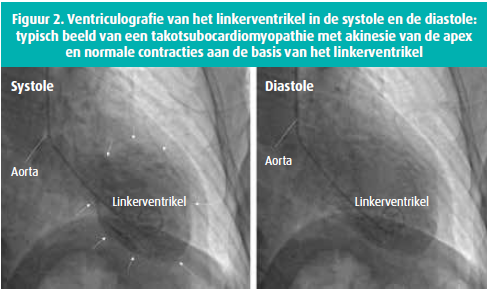
Een echocardiografie toont een duidelijke hypokinesie apicaal en anteroapicaal. De linkerventrikelejectiefractie is 55 %. Gezien de coronaire risicofactoren, de ecg-afwijkingen en de echocardiografische bevindingen wordt een coronariografie uitgevoerd. Die toont geen significante coronaire letsels. De ventriculografie toont het typische beeld van apicale akinesie met een normale contractiliteit van de basis van het linkerventrikel (figuur 2). De cardiale evolutie is zeer geruststellend. De pati ënte heeft het ziekenhuis verlaten met de volgende behandeling: bisoprolol 2,5 mg (lagere dosering gezien de lage hartfrequentie), perindopril 5 mg en spironolacton/altizide 25 mg/15 mg.
Bespreking van de klinische casus
Takotsubocardiomyopathie is voor het eerst beschreven in 1990.9 Het betreft een reversibel linkerhartfalen, meestal na positieve of negatieve emotionele of lichamelijke stress. Soms wordt echter geen uitlokkende factor teruggevonden. Het klinische beeld is dat van een acuut coronair syndroom: pijn in de borstkas, dyspneu, hartkloppingen.1, 5 Pati ënten met een takotsubocardiomyopathie na een epilepsieaanval klagen vaak niet over pijn in de borstkas.7
Bij de evaluatie wordt een coronariografie (of angio-CT-scan) aanbevolen om een coronaire trombus uit te sluiten.1 Tabel 1 vat de zeven diagnostische criteria van takotsubocardiomyopathie samen. De diagnose stoelt op vier paraklinische onderzoeken1, 5:
- Het ecg toont een ST-segmentelevatie zonder wijziging van de T-top en/of een verlengd QT-interval.
- Een echocardiografie toont een apicale akinesie en een hyperkinetische basis van het linkerventrikel met vaak een verminderde linkerventrikelejectiefractie.
- Een coronariografie sluit meestal een coronaire stenose of occlusieve trombus uit. Ongeveer 15 % van de pati ënten met een takotsubocardiomyopathie vertoont significant coronairlijden bij coronariografie.5
- De hartenzymen zijn verhoogd, maar niet in verhouding tot de ernst van de myocarddisfunctie.

De juiste incidentie van takotsubocardiomyopathie is nog niet bekend, maar het syndroom blijkt vaker voor te komen dan gedacht.1 De frequentste risicofactoren zijn het vrouwelijke geslacht, leeftijd van meer dan 60 jaar, menopauze en Japanse of Aziatische herkomst. De pati ënten vertonen vaker neurologische of psychiatrische aandoeningen dan pati ënten met een acuut coronair syndroom.5
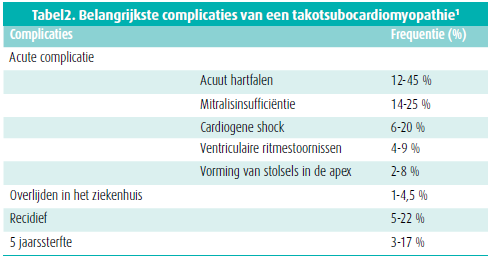
De prognose is over het algemeen gunstig. De hartfunctie herstelt volledig na enkele weken. Acute complicaties zijn evenwel mogelijk: cardiogene shock, trombusvorming, optreden van ritmestoornissen en zelfs overlijden.1 Tabel 2 toont de incidentie van de belangrijkste complicaties.
De behandeling hangt af van de ernst van het hartfalen. Ook is het raadzaam de uitlokkende factor te behandelen. Een supportieve behandeling is wenselijk om complicaties te vermijden. Elektrocardiografische monitoring is ge ïndiceerd, gezien het risico op dodelijke ventriculaire ritmestoornissen. Onze groep heeft een geval van gereanimeerde plotselinge dood beschreven.10 Als de linkerventrikelejectiefractie gedaald is, raden de richtlijnen een behandeling voor hartfalen aan met b ètablokkers en ACE-remmers (angiotensineconverterendenzymremmers). Toediening van catecholamines en andere vasoactieve geneesmiddelen tijdens de acute fase is omstreden, aangezien catecholamines meespelen bij de pathofysiologie (zie verder).1 Een alternatief in geval van cardiogene shock is levosimendan, een calciumsensibiliserend, niet-adrenerg inotroop middel.11
De pathofysiologie van takotsubocardiomyopathie is nog niet duidelijk: genetische vatbaarheid (gezien de hogere prevalentie in Japan), oestrogeendefici ëntie (gezien het hoge aantal gevallen bij gemenopauzeerde vrouwen) en metabole afwijkingen (gedetecteerd met een PET-scan) als gevolg van stress en niet als gevolg van coronairlijden.5-12 De theorie die momenteel het meeste aanhang vindt, is die van een disproportionele catecholaminerge ontlading van het bijniermerg en de sympathische zenuwen. Bij stress stijgt de concentratie endogene catecholamines, die toxisch zouden kunnen zijn voor de cardiomyocyten en het vaatendotheel. Sommige auteurs gewagen van een disfunctie van de microcirculatie en coronaire microspasmen als gevolg van een sterke vasoconstrictie. Er bestaat een zeer sterke link tussen het hart en de hersenen: een anatomische link via het autonome zenuwstelsel en een hormonale link via de suprarenale hypothalamus-hypofyseas. Die laatste kan cortico ïden afgeven, waardoor de contractiliteit van het hart en de vasomotorische tonus toenemen.13 Onze groep heeft een geval van 'iatrogene ' takotsubocardiomyopathie beschreven na een verkeerde injectie van adrenaline.14
De echocardiografische afwijkingen bij een takotsubocardiomyopathie zijn compatibel met het feit dat de autonome bezenuwing meer verspreid is van de basis naar de apex van het linkerventrikel toe, en het feit dat het aantal adrenerge ß2-receptoren, die een negatief inotroop effect hebben, daalt van de apex naar de basis toe.13 De distributie van de regionale myocarddisfunctie is niet compatibel met het territorium van een kransslagader Het is bekend dat epilepsieaanvallen een takotsubocardiomyopathie kunnen uitlokken;3-8 de meest waarschijnlijke hypothese is dat een tonisch-klonische aanval of een status epilepticus het orthosympathische zenuwstelsel activeert, waardoor de systemische catecholamines stijgen. Linkerhartfalen met acute ademnood zou een aantal gevallen van SUDEP (Sudden Unexpected Death in Epilepsy) kunnen verklaren. Er zijn gevallen van fatale ventrikelfibrillatie gerapporteerd. De systemische hoeveelheid catecholamines zou afhangen van de duur en de intensiteit van de aanvallen. Preventieve toediening van alfa- en b ètablokkers om de 'catecholaminerge storm ' op te vangen zou pati ënten die risico lopen op een SUDEP kunnen beschermen. Dat zijn vaak mannelijke pati ënten die epilepsie krijgen op jonge leeftijd en herhaalde tonisch-klonische aanvallen vertonen. De frequentie van takotsubocardiomyopathie na een epilepsieaanval zou 1 % bedragen.2 Er wordt een verband met SUDEP vermoed. Daarom is een intensieve follow-up met cardiale monitoring raadzaam.7-8 Een takotsubocardiomyopathie na een epilepsieaanval kan recidiveren. Daarom moet de anti-epileptische behandeling worden opgedreven.7
Niet alle experts zijn het daar echter over eens, gezien de meestal spontaan gunstige evolutie van de aandoening, ongeacht de cardiale behandeling zoals profylactische toediening van b ètablokkers. Dat zou dus niet noodzakelijk zijn bij alle epilepsiepati ënten die een takotsubocardiomyopathie dreigen te ontwikkelen.8
Er zijn tal van neurologische stressoren die een takotsubocardiomyopathie zouden kunnen uitlokken: acute neurochirurgische urgenties (hersenbloeding, hersen- of ruggenmergtrauma), encefalitis en cerebrovasculair accident (CVA).1, 5 Er wordt veel onderzoek verricht naar de interactie tussen het hart en de hersenen en naar de pathofysiologie van die interactie.15 De kettingreactie zou altijd dezelfde zijn, ongeacht het onderliggende neurologische letsel: lokale neuro-ontsteking, stijging van de intracraniale druk en activering van de neuro-endocriene wegen. Dat alles zou leiden tot een systemische en lokale stijging van de catecholamines en tot de afgifte van cytokines, met directe effecten op de cardiomyocyten. Er zijn nog andere factoren die die wegen kunnen activeren, zoals een feochromocytoom, het gebruik van drugs en septische shock.
Het opmerkelijke aan onze casus zijn de neurologische trigger en de klinische kenmerken van takotsubocardiomyopathie. Gelukkig hebben we geen complicaties geobjectiveerd.
Conclusie
Er wordt veel onderzoek verricht naar de interactie tussen de hersenen en het hart. Een gemeenschappelijke aanpak is wenselijk. Bij elke tonisch-klonische epilepsieaanval of andere ernstige neurologische aandoening (zoals een subarachno ïdale bloeding) zou een hartonderzoek uitgevoerd moeten worden: evolutie van de troponinespiegel, ecg en echocardiografie. Bij vermoeden van disfunctie van het myocard is telemetrie raadzaam. Die follow-up zal misschien niet de sterfte van de pati ënten verlagen, maar zou de behandeling kunnen verbeteren. Uiteraard moeten een acuut coronair syndroom en de complicaties ervan uitgesloten worden.
Referenties
- Lion, A.R., Bossone, E., Schneider, B., et al. Current state of knowledge on Takotsubo syndrome: a position statement from the task force on Takotsubo syndrome of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2016, 18, 8-27.
- Boland, T.A., Lee, V.H., Bleck, T.P. Stress-induced cardiomyopathy. Crit Care Med, 2015, 43, 686-693.
- Lemke, D.M., Hussain, S.I., Wolfe, T.J., et al. Tako-Tsubo cardiomyopathy associated with seizures. Neurocritical Care, 2008, 9, 112-117.
- Le Ven, F., Pennec, P.Y., Timsit, S., Blanc, J.J. Takotsubo syndrome associated with seizures: an underestimated cause of sudden death in epilepsy? Int J Cardiol, 2011, 146, 475-479
- Templin, C., Ghadri, J.R., Diekmann, J., et al. Clinical features and outcomes of Takotsubo (stress) cardiomyopathy. N Engl J Med, 2015, 373, 929-938.
- Spagnolo, S., Outin, H., Le syndrome de Takotsubo: au coeur de l ' état de mal épileptique. Epilepsies, 2010, 22, 212-216.
- Dupuis, M., van Rijkevorsel, K., Evrard, F. et al. Takotsubo syndrome (TKS): A possible mechanism of sudden unexplained death in epilepsy (SUDEP). Seizure, 2012, 21, 51-54.
- Finsterer, J., Bersano, A. Seizure-triggered Takotsubo syndrome rarely causes SUDEP. Seizure, 2015, 31, 84-87.
- Sato, H.T.H., Uchida, T., Dote, K., Ishihara, M. Tako-tsubo-like left ventricular dysfunction due to multivessel coronary spasm. In: Kodama, K., Haze, K., Hori, M. eds. Clinical aspect of myocardial injury: from ischemia to heart failure. Tokyo: Kagakuhyoronsha Publishing, 1990: 56-64. (In Japanese.)
- Laruelle, M., Seront, B., Marcovitch, O. et al. La cardiomyopathie de Tako-Tsubo; une cause m éconnue de mort subite. Revue clinique en 2011. J Cardiol, 2011, 23, 439-445.
- Righetti, F.R., Parolini, M.P., Castellano, G.C.. Levosimendan versus dobutamine in Tako-tsubo cardiomyopathy. Critical Care, 2013, 17 (Suppl 2), P227 (doi: 10.1186/cc12165).
- Yoshida, T., Hibino, T., Kako, N., et al. A physiopathologic study of Tako-Tsubo cardiomyopathy with F-18 fluorodeoxyglucose positron emisson tomography. Eur Heart J, 2007, 28, 2598-2604.
- Finsterer, J., Wahbi, K. Cardiac disease in brain-heart disorders. Acta Cardiol, 2016, 71, 389-394.
- Munyentwali, H., de Meester, A. Cardiomyopathie de Tako-Tsubo: cas clinique 'iatrog ène ' et revue de la litt érature. Louvain Med, 2009, 128, 177-181.
- Krishnamoorthy, V., Mackensen, G., Gibbons, E., Vavilala, M. Cardiac dysfunction after neurologic injury. What do we know and where are we going? Chest, 2016, 149, 1325-1331.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.