Inleiding
Driedimensionale rotationele angiografie (3DRA) is een innovatieve methode die toelaat via tomografische snedes reconstructies van een volume naar keuze te maken via single plane radiografische apparatuur.
Het gereconstrueerde 3D-model correleert goed met een CT-model en kan ter vervanging van conventionele CT- of MRI-beelden gebruikt en geïntegreerd worden in beschikbare visualisatie- en navigatiesystemen die aanwezig zijn in het cathlab. In tegenstelling tot CT of MRI maakt deze technologie het mogelijk om realtime beelden in 3D te verkrijgen zodat er bij dergelijke integratie geen mismatch mogelijk is door veranderingen in volumestatus, onderliggend hartritme of geometrische variabelen - deze mismatch kan optreden als er meer dan meerdere uren verlopen zijn tussen het verkrijgen van een conventionele CT en het uitvoeren van een interventionele procedure.
3DRA zorgt dan ook voor een beter begrip van anatomie, vergemakkelijkt 3D-katheternavigatie, verkort de proceduretijd en zorgt voor een verminderde stralingsbelasting. In dit kort overzicht zullen we wat dieper ingaan op enkele toepassingen in de klinische praktijk.
Rol van driedimensionale rotationele angiografie bij de behandeling van voorkamerfibrillatie
Voorkamerfibrillatie is de meest voorkomende ritmestoornis en de leeftijdsgerelateerde aard van de aandoening maakt dat de incidentie alleen maar zal toenemen. Katheterablatie is een door internationale richtlijnen aanvaarde eerstelijnsbehandeling voor symptomatische voorkamerfibrillatie en voor voorkamerfibrillatie resistent tegen medicamenteuze behandeling (klasse I voor paroxismale VKF en klasse IIc voor persistente VKF).1 Het is dan ook het typevoorbeeld voor de creatie van een workflow waarbij 3DRA een rol speelt gezien de sterk anatomisch gedreven aard van de behandeling en het hoge aantal procedures.
De huidige standard of care bestaat uit pulmonalevenen-isolatie (PVI) door radiofrequentie-energie of alternatieven (cryo, laser…). De behandelingsstrategie kende een duidelijke evolutie van een elektrofysiologisch-geleide behandeling (triggereliminatie in de pulmonale venen) naar een meer empirische behandeling door creatie van circulaire laesies rond de pulmonale venen. Deze evolutie zorgde voor een toenemende complexiteit van de procedure, vooral door de vereiste van correcte katheterpositionering in de complexe anatomische ruimte van het linker atrium.
Het linker atrium kent weinig fluoroscopische landmarks, waardoor 'gewone' tweedimensionale fluoroscopie tekortschiet. Daarenboven vereist veilige en succesvolle PVI de precieze afgifte van energie ter hoogte van cruciale complexe 3D-structuren, zoals de transitiezone tussen de linker superior pulmonale vene (LSPV) en het linker hartoor.
Door integratie van 3DRA (compleet en gedetailleerde beeldvorming, evenwaardig aan CT) en elektro-anatomische mapping (EAM, waarbij kathetermanipulatie mogelijk wordt zonder fluoroscopie) kan een goed reproduceerbare workflow gecreëerd worden. Hierdoor wordt de proceduretijd ingekort en neemt de stralingsbelasting af. Hiernaast mogen we een effectieve en veilige procedure verwachten.2
Controle van de accuraatheid van de geïntegreerde procedure (3DRA/EAM) door bijvoorbeeld 'contact force sensing', waarbij contact van de ablatiekatheter met de gevisualiseerde wand wordt vastgesteld, zorgt ervoor dat de operator kan vertrouwen op het 3DRA-model en er geen fluoroscopie meer nodig is tijdens het verdere verloop van de procedure. Als de spatiële resolutie van het 3DRA-model hoog genoeg is, is er alleen fluoroscopie nodig bij de initiële setup, de transseptale punctie en de katheterplaatsing. Routineuze radiatiedosissen tijdens onze procedures bevestigen effectieve stralingsdosissen rond 1 mSv voor patiënten en rond 0,2 μSv voor de operator.3 Dit is beduidend lager dan wat gerapporteerd werd in een recente review, waarbij de gemiddelde stralingsdosis per procedure 16,6 mSv bedroeg.4
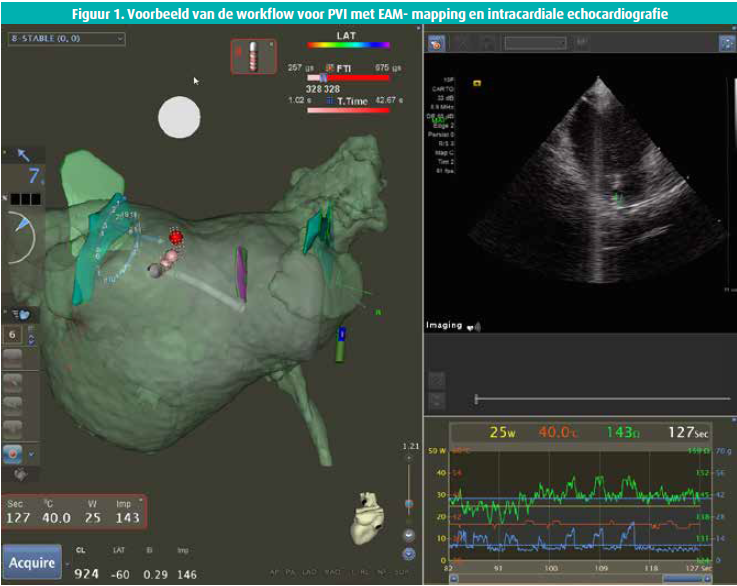
Figuur 1 geeft een voorbeeld weer van de workflow voor PVI met EAM-mapping en intracardiale echocardiografie (ICE) voor back-up verificatiedoeleinden. Op de figuur is het 3DRA-volume (semitransparant groen), het EAM-volume (semitransparant grijs) en de ICE-structuren te zien (groen en paars, markeren van left common ostium, RIPV en slokdarm).
Driedimensionale rotationele angiografie-geleide sluiting van het linker hartoor
Percutane sluiting van het linker hartoortje is een interventionele behandeling met een rol binnen de preventie van een recidief CVA bij patiënten met risico op trombusformatie en een contra-indicatie voor anticoagulantia. De procedure wordt actueel vooral ondersteund door het gebruik van tweedimensionale transoesofagale echocardiografie (TEE) in combinatie met fluoroscopie.5 Een alternatief bestaat uit het gebruik van 3DRA in deze setting.
Met een pilootstudie evalueerden we prospectief het gebruik en de veiligheid van 3DRA met oog op correcte sizing en positionering van het closuredevice als alternatief voor TEE-geleide procedures.6
In totaal werden 20 procedures uitgevoerd. Eén procedure moest afgebroken worden vanwege accesproblemen. Bij de overige 19 patiënten werd de inschatting van devicegrootte, de plaatsing, stabilisatie en evaluatie van lekkage uitgevoerd met fluoroscopie en 3DRA. Retrospectieve analyse van TEE- en DRA-datasets toonde een maximale ostiale LAA-diameter van 21 ± 3 mm met TEE versus 24,3 ± 3,5 mm met 3DRA (p < 0,05; R2 = 0,64). In alle gevallen werd de grootste diameter teruggevonden in de 3DRA-dataset (systematische bias, TEE onderschat diameter met gemiddeld 3,45 mm in vergelijking met 3DRA). Het device werd succesvol geplaatst in alle 19 casussen. In één casus bleek het ostiale linker hartoor te groot en ongeschikt voor deviceloslating. De maximale diameter gemeten met TEE was 27 mm bij deze patiënt, wat suggereerde dat zij een goede kandidate was voor implantatie maar met 3DRA werd een maximale diameter van 30,5 mm gemeten, wat inderdaad buiten de werkbare range voor implantatie valt. Alle procedures verliepen ongecompliceerd. Bij een follow-up na 6 weken deden er zich geen relevante complicaties voor.
Uiteraard is deze studie gelimiteerd door het beperkt aantal patiënten maar hoe dan ook lijkt er ons een workflow mogelijk waarbij LAA-sluiting uitgevoerd kan worden zonder TEE-begeleiding. Daarenboven doen er zich bij 2D-TEE problemen voor wat betreft sizing van het device.
Succesvolle percutane stenting van pulmonalevenestenose met behulp van 3DRA
Pulmonalevenestenose na radiofrequentieablatie voor voorkamerfibrillatie is een zeldzame maar ernstige complicatie, meestal behandeld met percutane stenting.7
We illustreren het nut van 3DRA bij stenting van pulmonale venen aan de hand van de volgende casus.
Een 53-jarige vrouw onderging drie jaar eerder PVI met radiofrequentie voor voorkamerfibrillatie. Postprocedureel trad er ernstige pulmonalevenestenose op. Open chirurgische veneuze reconstructie was onsuccesvol.
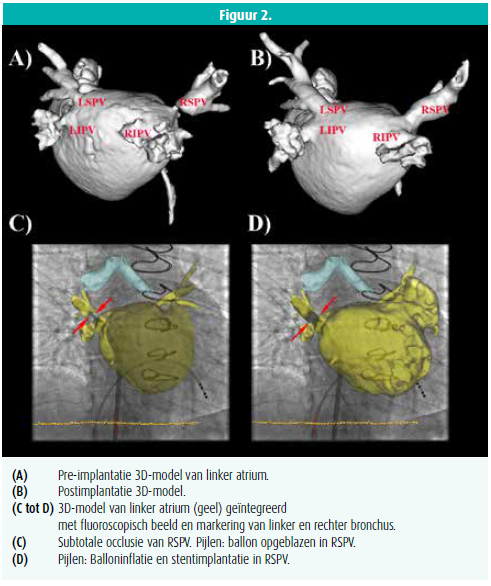
Na het verkrijgen van 3DRA van het linker atrium werd dit gesegmenteerd en geïntegreerd in het 3D-navigatiesysteem (figuur 2). 3DRA toonde een ernstige stenose in de linker superior PV, linker inferior PV en subtotale stenose in de rechter superior PV. Een stent werd geplaatst in de venen op geleide van het 3D-model, geïntegreerd met live fluoroscopie. Het 3D-model liet toe de precieze lengte en plaatsing van de stent live te beoordelen per individuele vene. De procedure was succesvol met gunstige klinische opvolging.8
Linkeratriumvolume berekend door 3DRA als predictor voor recidive van voorkamerfibrillatie na PVI
Linkeratriumvolume is een goed bestudeerde voorspeller voor het risico op een recidive van voorkamerfibrillatie na PVI. Wel is er discussie over de beste beeldvormingsmodaliteit en de meest gepaste parameter.9, 10 Volumebepaling met 3DRA (3DRA-LAVI) zou een mogelijk valabel alternatief zijn voor de klassieke bepaling met TTE. In de studieopzet onderzochten we of 3DRA-LAVI-bepaling tijdens een PVI-procedure het risico op een recidief van VKF kon voorspellen.11 Hierbij werden 352 patiënten met paroxismale of persistente VKF geïncludeerd. LAVI werd berekend door middel van TTE en 3DRA bij alle patiënten. Gemiddelde TTE-LAVI en 3DRA-LAVI waren 37 ± 12 en 83 ± 18 ml/m2 respectievelijk. Na een follow-up van 19 maanden had 27 % van de patiënten een recidief van VKF. Bij univariate analyse was er een significante, positieve correlatie met 3DRA-LAVI (p < 0,01). Hiertegenover staat dat er geen enkele echocardiografische parameter significant geassocieerd was met recidief-events. Bij multivariate analyse bleek 3DRA-LAVI de enige onafhankelijke voorspeller (HR 1,01 [1,00-1,03], p = 0,017).
Uit deze studie kunnen we dus concluderen dat 3DRA LAVI beter in staat is dan echocardiografie om de kans op recidief na PVI te voorspellen. Verder onderzoek is noodzakelijk om te bekijken of deze parameter ook kan helpen om bij hoogrisicopatiënten een andere ablatiestrategie uit te voeren, anticoagulatie al dan niet te onderbreken en/of antiaritmica al dan niet te continueren.
Conclusie
De vele mogelijkheden van 3DRA stellen ons in staat om binnen verschillende settings een maximale anatomische accuraatheid na te streven. Dit laat ons toe om complexe procedures op een veilige, snelle en efficiënte wijze uit te voeren.
Referenties
- Kirchhof, P., Benussi, S., Kotecha, D., Ahlsson, A., Atar, D., Casadei, B., et al. ESC guidelines for the management of atrial brillation developed in collabora- tion with EACTS. Eur Heart J, 2016, 37 (38), 2893-2962.
- Dong, J., Dickfeld, T., Dalal, D., et al. Initial experience in the use of integrated electroanatomic mapping with three- dimensional MR/CT images to guide catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2006, 17, 459-466.
- De Potter, T., Bardhaj, G., Viggiano, A., Morrice, K., Geelen, P. Three-dimensional rotational angiography as a periprocedural imaging tool in atrial fibrillation ablation. Arrhythm Electrophysiol Rev, 2014, 3 (3), 173-176.
- Heidbuchel, H., Wittkampf, F.H., Vano, E., Ernst, S., Schilling, R., Picano, E. et al. Practical ways to reduce radiation dose for patients and staff during device implantations and electrophysiological procedures. Europace, 2014, 16 (7), 946-964.
- Pison, L., Potpara, T.S., Chen, J., et al. Left atrial appendage closure-indications, techniques, and outcomes: results of the European Heart Rhythm Association Survey. Europace, 2015, 17, 642-646.
- De Potter, T., Chatzikyriakou, S., Silva, E., Van Camp, G., Penicka, M. A Pilot Study for Left Atrial Appendage Occlusion Guided by 3-Dimensional Rotational Angiography Alone. JACC Cardiovasc Interv, 2018, 11 (2), 223-224.
- Holmes, D.R. Jr., Monahan, K.H., Packer, D. Pulmonary vein stenosis complicating ablation for atrial fibrillation: clinical spectrum and interventional considerations. JACC Cardiovasc Interv, 2009, 2, 267-276.
- De Potter, T., Silva Garcia, E., Beelen, R., Chatzikyriakou, S. Successful Percutaneous Stenting of Severe Radiofrequency-Induced Pulmonary Vein Stenosis in 3 Veins Post-Failed Surgical Correction. JACC Cardiovasc Interv, 2017, 10 (3), :e17-e19.
- Koka, A.R., Yau, J., Van Why, C., Cohen, I.S., Halpern, E.J. Underestimation of left atrial size measured with transthoracic echocardiography compared with 3D MDCT. AJR Am J Roent-genol, 2010, 194 (5), W375-W381.
- Olshansky, B., Heller, E.N., Mitchell, L.B., Chandler, M., Slater, W., Green, M. et al. Are transthoracic echocardiographic parameters associated with atrial fibrillation recurrence or stroke? Results from the atrial fibrillation follow-up investigation of rhythm management (AFFIRM) study. J Am Coll Cardiol, 2005, 45 (12), 2026-2033.
- Strisciuglio, T., Di Gioia, G., Chatzikyriakou, S., Silva Garcia, E., Barbato, E., Geelen, P., De Potter, T. Left atrial volume computed by 3D rotational angiography best predicts atrial fibrillation recurrence after circumferential pulmonary vein isolation. Int J Cardiovasc Imaging, 2018, 34 (3), 337-342.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.