Introduction
L'angiographie rotationnelle tridimensionnelle (AR3D) est une méthode innovante qui permet la reconstruction d'un volume au choix au moyen de coupes tomographiques, en utilisant un appareil de radiographie monoplan.
Le modèle 3D obtenu par reconstruction présente une bonne corrélation avec un modèle obtenu par tomodensitométrie (CT). Il peut être utilisé à la place des clichés d'imagerie conventionnelle par CT ou IRM et il peut être intégré dans les systèmes de visualisation et de navigation disponibles dans le laboratoire de cathétérisme. Contrairement à la CT ou à l'IRM, cette technologie permet d'obtenir des images 3D en temps réel afin d'éviter pendant l'intégration tout décalage secondaire à des modifications du statut volumique, du rythme cardiaque sousjacent ou de variables géométriques - ce décalage peut survenir si un délai supérieur à quelques heures s'écoule entre l'obtention d'un cliché par CT conventionnelle et le moment de la procédure interventionnelle.
L'AR3D favorise également une meilleure compréhension de l'anatomie, elle facilite la navigation du cathéter en 3D, raccourcit la durée de l'intervention et permet de réduire la charge d'irradiation. Ce bref résumé abordera d'une manière un peu plus détaillée quelques applications de cette technique en pratique clinique.
Rôle de l'angiographie rotationnelle tridimensionnelle dans le traitement de la fibrillation auriculaire
La fibrillation auriculaire est le trouble du rythme le plus fréquent, et le caractère lié à l'âge de l'affection est tel que son incidence ne fera qu'augmenter. L'ablation par cathéter est le traitement de première ligne approuvé par les directives internationales pour la fibrillation auriculaire symptomatique et pour la fibrillation auriculaire résistante au traitement médicamenteux (classe I pour la FA paroxystique et classe IIc pour la FA persistante).1 Il s'agit dès lors de l'exemple type pour la création d'un flux de travail où l'AR3D joue un rôle, compte tenu de la nature du traitement, qui est très ciblée sur l'anatomie, et du nombre élevé de procédures.
Le traitement standard actuel consiste à pratiquer une isolation des veines pulmonaires (IVP) par énergie de radiofréquence ou en utilisant d'autres techniques (cryo, laser…). L'évolution de la stratégie thérapeutique est considérable, passant d'un traitement de type électrophysiologique (élimination du foyer déclencheur situé au niveau des veines pulmonaires) à un traitement plus empirique par la création de lésions circulaires autour des veines pulmonaires. Cette évolution implique une complexité croissante de l'intervention, qui résulte principalement de la nécessité absolue d'un positionnement correct du cathéter dans l'espace anatomique complexe de l'oreillette gauche.
étant donné que l'oreillette gauche présente peu de repères fluoroscopiques, la fluoroscopie bidimensionnelle 'classique' n'est pas suffisante. De plus, la réalisation d'une IVP sûre et efficace requiert une délivrance précise d'énergie au niveau de structures complexes et cruciales visualisées en 3D, telles que la zone de transition située entre la veine pulmonaire supérieure gauche (VPSG) et l'oreillette gauche.
L'intégration de l'AR3D (imagerie complète et détaillée, de même valeur que la CT) et la cartographie électro-anatomique (CEA, une technique rendant possible la manipulation du cathéter sans fluoroscopie) permettent la création d'un bon flux de travail reproductible. La durée de l'intervention devient ainsi plus courte et la charge d'irradiation est plus faible. On peut ainsi disposer d'une procédure sûre et efficace.2
Le contrôle de la précision de la procédure intégrée (AR3D/CEA), par exemple à l'aide d'une 'mesure de la force de contact' du cathéter d'ablation avec la paroi visualisée, permet à l'opérateur d'obtenir un modèle d'AR3D fiable et de ne plus recourir à la fluoroscopie pendant le reste de l'intervention. Si la résolution spatiale du modèle d'AR3D est suffisamment élevée, la fluoroscopie n'est nécessaire qu'au moment du réglage initial, de la ponction transseptale et de la mise en place du cathéter. Les doses d'irradiation habituellement utilisées pendant nos procédures impliquent une exposition à des doses d'irradiation efficaces d'environ 1 mSv pour les patients et d'environ 0,2 μSv pour l'opérateur.3 Cette exposition est significativement plus faible que celle qui a été décrite au cours d'une évaluation récente ayant mentionné une dose d'irradiation moyenne de 16,6 mSv par procédure.4
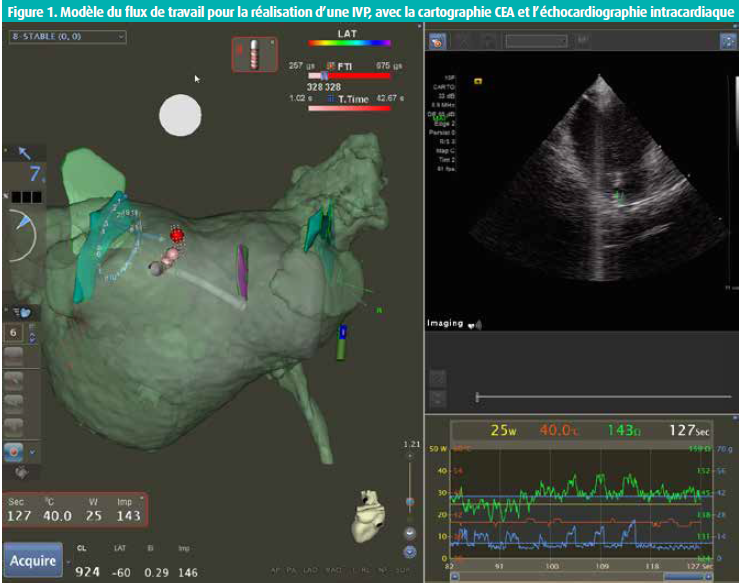
La figure 1 montre un modèle du flux de travail pour la réalisation d'une IVP, avec la cartographie CEA et l'échocardiographie intracardiaque (EIC) en vue d'une vérification de type back-up. Sur la figure, on peut visualiser le volume AR3D (en vert semi-transparent), le volume CEA (en gris semi-transparent) et les structures EIC (en vert et violet, marquage de l'ostium commun gauche, de la VPID et de l'oesophage).
Fermeture de l'oreillette gauche dirigée par angiographie rotationnelle tridimensionnelle
La fermeture percutanée de l'oreillette gauche est un traitement interventionnel ayant un rôle dans la prévention d'une récidive d'AVC chez les patients présentant un risque de formation de thrombus et une contre-indication au traitement anticoagulant. L'intervention s'effectue actuellement en utilisant l'échocardiographie transoesophagienne bidimensionnelle (ETO) en association avec la fluoroscopie.5 Une alternative consiste à utiliser l'AR3D dans cette situation.
Au cours d'une étude pilote, nous avons procédé à une évaluation prospective de l'utilisation et de la sécurité de l'AR3D comme alternative aux interventions dirigées par ETO, en analysant plus spécifiquement le caractère correct de la détermination de la taille et du positionnement du dispositif de fermeture.6
Au total, 20 interventions ont été pratiquées. Une seule d'entre elles a dû être interrompue en raison de problèmes d'accès. Chez les 19 autres patients, l'estimation de la taille du dispositif, la mise en place, la stabilisation et l'évaluation des éventuelles fuites résiduelles ont été réalisées au moyen de la fluoroscopie et de l'AR3D. L'analyse rétrospective des sets de données pour l'ETO et l'AR3D a révélé un diamètre maximal de l'ostium de l'AAG de 21 ± 3 mm avec l'ETO et de 24,3 ± 3,5 mm avec l'AR3D (p < 0,05 ; R2 = 0,64). Dans tous les cas, le plus grand diamètre a été observé dans le set de données pour l'AR3D (biais systématique, l'ETO sous-estime le diamètre d'en moyenne 3,45 mm par rapport à l'AR3D). Le dispositif a pu être mis en place correctement dans les 19 cas. Dans un seul cas, l'ostium de l'oreillette gauche était trop grand, le dispositif était donc de taille inadéquate et se détachait. Le diamètre maximal mesuré par ETO était de 27 mm chez cette patiente, ce qui indiquait qu'elle était une bonne candidate pour l'implantation, mais le diamètre maximal mesuré par AR3D était de 30,5 mm, ce qui était en dehors des valeurs préconisées pour l'implantation. Toutes les interventions se sont déroulées sans complications. Au cours d'un suivi réalisé après 6 semaines, aucune complication significative n'a été constatée.
Cette étude présente bien sûr des limites en raison du faible nombre de patients, mais elle nous permet de constater qu'il est possible d'appliquer un flux de travail associé à la réalisation d'une fermeture de l'AAG non assistée par ETO. De plus, avec l'ETO en 2D, des problèmes peuvent se produire au niveau de la détermination de la taille du dispositif.
Pose d'un stent par voie percutanée à l'aide de l'AR3D pour le traitement d'une sténose d'une veine pulmonaire
La sténose d'une veine pulmonaire survenant après l'ablation d'une fibrillation auriculaire par radiofréquence est une complication rare mais sévère que l'on traite généralement par la pose d'un stent par voie percutanée.7
Le cas suivant illustre l'utilité de l'AR3D au cours de la pose d'un stent au niveau des veines pulmonaires.
Il y a trois ans, une femme âgée de 53 ans a subi une IVP par radiofréquence pour traiter une fibrillation auriculaire. Une sténose sévère d'une veine pulmonaire est survenue après l'intervention. Une reconstruction veineuse par chirurgie ouverte a été réalisée mais a échoué.
Le modèle de l'oreillette gauche obtenu par AR3D a été segmenté et intégré dans le système de navigation 3D (figure 2). L'AR3D a mis en évidence une sténose sévère de la VP supérieure gauche et de la VP inférieure gauche, ainsi qu'une sténose subtotale de la VP supérieure droite.
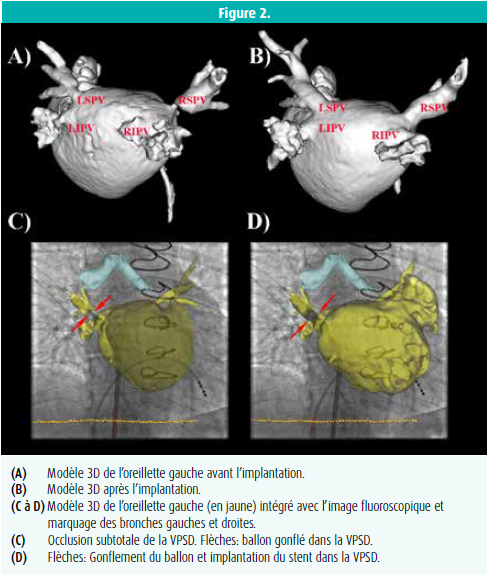
Un stent a été mis en place dans les veines en utilisant le modèle 3D intégré avec une fluoroscopie en temps réel. Pour chaque veine individuelle, le modèle 3D permet l'évaluation de la longueur précise du stent et sa mise en place en temps réel. L'intervention s'est déroulée sans problèmes, avec une évolution clinique favorable.8
Volume de l'oreillette gauche calculé par AR3D comme facteur prédictif d'une récidive de fibrillation auriculaire après une IVP
Le volume de l'oreillette gauche est un facteur prédictif bien étudié pour évaluer le risque de récidive d'une fibrillation auriculaire après une IVP. Il existe néanmoins un débat concernant la meilleure technique d'imagerie à utiliser et le paramètre le plus adéquat.9, 10 La détermination du volume par AR3D (IVOG-AR3D) pourrait être une alternative valable à la mesure classique par ETO. Dans le cadre de l'étude, nous avons évalué si le volume mesuré par IVOG-AR3D pendant la procédure d'IVP pouvait prédire le risque de récidive de FA.11 Nous avons donc inclus dans cette évaluation 352 patients ayant une FA paroxystique ou persistante. L'IVOG a été calculé par ETO et AR3D chez tous les patients. Les valeurs moyennes de l'IVOG obtenues avec l'ETO et l'AR3D étaient de respectivement 37 ± 12 et 83 ± 18 ml/m2.
Après un suivi de 19 mois, 27 % des patients ont présenté une récidive de FA. Au cours de l'analyse univariée, l'IVOGAR3D était significativement associé (p < 0,01) à une récidive de FA. De plus, on a également constaté qu'aucun paramètre échographique n'était significativement associé à la survenue d'une récidive. Au cours de l'analyse multivariée, l'IVOGAR3D semblait être le seul facteur prédictif indépendant de récidive d'une FA (HR 1,01 [1,00-1,03], p = 0,017).
Cette étude permet donc de conclure que la technique IVOG-AR3D est plus adéquate que l'échocardiographie pour prédire le risque de récidive après une IVP. Des investigations complémentaires sont nécessaires pour vérifier si ce paramètre peut également s'avérer utile pour adopter une autre technique d'ablation chez les patients à haut risque, pour décider d'interrompre ou non le traitement anticoagulant et/ou pour décider de continuer ou non le traitement antiarythmique.
Conclusion
Les nombreuses possibilités offertes par l'AR3D permettent d'obtenir une précision anatomique maximale dans diverses situations, ce qui favorise la réalisation sûre, rapide et efficace d'interventions complexes.
Références
- Kirchhof, P., Benussi, S., Kotecha, D., Ahlsson, A., Atar, D., Casadei, B., et al. ESC guidelines for the management of atrial brillation developed in collabora- tion with EACTS. Eur Heart J, 2016, 37 (38), 2893-2962.
- Dong, J., Dickfeld, T., Dalal, D., et al. Initial experience in the use of integrated electroanatomic mapping with three- dimensional MR/CT images to guide catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2006, 17, 459-466.
- De Potter, T., Bardhaj, G., Viggiano, A., Morrice, K., Geelen, P. Three-dimensional rotational angiography as a periprocedural imaging tool in atrial fibrillation ablation. Arrhythm Electrophysiol Rev, 2014, 3 (3), 173-176.
- Heidbuchel, H., Wittkampf, F.H., Vano, E., Ernst, S., Schilling, R., Picano, E. et al. Practical ways to reduce radiation dose for patients and staff during device implantations and electrophysiological procedures. Europace, 2014, 16 (7), 946-964.
- Pison, L., Potpara, T.S., Chen, J., et al. Left atrial appendage closure-indications, techniques, and outcomes: results of the European Heart Rhythm Association Survey. Europace, 2015, 17, 642-646.
- De Potter, T., Chatzikyriakou, S., Silva, E., Van Camp, G., Penicka, M. A Pilot Study for Left Atrial Appendage Occlusion Guided by 3-Dimensional Rotational Angiography Alone. JACC Cardiovasc Interv, 2018, 11 (2), 223-224.
- Holmes, D.R. Jr., Monahan, K.H., Packer, D. Pulmonary vein stenosis complicating ablation for atrial fibrillation: clinical spectrum and interventional considerations. JACC Cardiovasc Interv, 2009, 2, 267-276.
- De Potter, T., Silva Garcia, E., Beelen, R., Chatzikyriakou, S. Successful Percutaneous Stenting of Severe Radiofrequency-Induced Pulmonary Vein Stenosis in 3 Veins Post-Failed Surgical Correction. JACC Cardiovasc Interv, 2017, 10 (3), :e17-e19.
- Koka, A.R., Yau, J., Van Why, C., Cohen, I.S., Halpern, E.J. Underestimation of left atrial size measured with transthoracic echocardiography compared with 3D MDCT. AJR Am J Roent-genol, 2010, 194 (5), W375-W381.
- Olshansky, B., Heller, E.N., Mitchell, L.B., Chandler, M., Slater, W., Green, M. et al. Are transthoracic echocardiographic parameters associated with atrial fibrillation recurrence or stroke? Results from the atrial fibrillation follow-up investigation of rhythm management (AFFIRM) study. J Am Coll Cardiol, 2005, 45 (12), 2026-2033.
- Strisciuglio, T., Di Gioia, G., Chatzikyriakou, S., Silva Garcia, E., Barbato, E., Geelen, P., De Potter, T. Left atrial volume computed by 3D rotational angiography best predicts atrial fibrillation recurrence after circumferential pulmonary vein isolation. Int J Cardiovasc Imaging, 2018, 34 (3), 337-342.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.