Linkerbundeltakblok is sinds het tijdperk van cardialeresynchronisatietherapie geëvolueerd van een louter elektrocardiografische bevinding tot een cardiale entiteit op zich.
Inleiding
De aanwezigheid van linkerbundeltakblok (LBTB) op het elektrocardiogram (ecg) zal de clinicus alarmeren vanwege de associatie met verhoogde cardiovasculaire mortaliteit, plotse cardiale dood en hartfalen. De elektrocardiografische diagnose van LBTB zal dan ook vaak aanleiding geven tot bijkomende onderzoeken en verdere cardiale opvolging vereisen1. LBTB werd meer dan een eeuw geleden voor het eerst beschreven als elektrocardiografische diagnose. Nieuwe inzichten hebben er de voorbije decennia toe geleid dat LBTB niet meer louter een elektrocardiografische bevinding is, maar eerder beschouwd wordt als een complete cardiale entiteit met een eigen pathofysiologie, diagnostiek en therapeutische benadering. In dit artikel lichten we de belangrijkste facetten van deze geleidingsstoornis toe op basis van recente inzichten uit experimenteel en klinisch wetenschappelijk onderzoek.
Epidemiologie, etiologie en prognose
De prevalentie van LBTB in de algemene bevolking is laag (< 1 %) en neemt toe met de leeftijd, van 0,5 % op 50-jarige leeftijd tot 5 % op 80-jarige leeftijd2. Aangezien een LBTB meestal onopgemerkt ontstaat, zijn er maar weinig gegevens over de etiologie en het precieze ontstaansmechanisme bekend. Uit longitudinale studies weten we dat LBTB een associatie heeft met arteriële hypertensie, coronair lijden, kleplijden, myocarditis, cardiomyopathie en linkerventrikelhypertrofie1. Decennialang werd aangenomen dat LBTB louter een elektrocardiografische handtekening was van deze onderliggende cardiale aandoeningen. Zowel observationele studies als dierproeven toonden echter aan dat de aanwezigheid van LBTB een rechtstreekse en onafhankelijke invloed uitoefent op de linkerventrikelfunctie, en dus zelf aanleiding kan geven tot hartfalen met een gedaalde ejectiefractie. Hierdoor is LBTB op zichzelf een onafhankelijke predictor van mortaliteit binnen deze patiëntenpopulatie. Dit laatste wordt bovendien bevestigd door het gunstig effect op mortaliteit dat succesvolle cardialeresynchronisatietherapie (CRT) teweeg kan brengen bij de LBTB-patiënt met hartfalen3-5. De aanwezigheid van LBTB zonder onderliggend cardiaal lijden is zeldzaam (< 0,1 % van de totale populatie)1. Het risico op hartfalen en mortaliteit bij ogenschijnlijk gezonde individuen met een nieuwe diagnose van LBTB, is minder goed gedocumenteerd5. Dat komt door de erg lage prevalentie in deze populatie en het onopgemerkt ontstaan, waardoor LBTB vaak een toevalsvondst is. Jaarlijkse opvolging van deze patiënten met echocardiografie is in dat geval gewettigd5, 6. Naast een negatieve invloed op de systolische en diastolische functie van zowel linker als rechter ventrikel, kan door LBTB mitralisklepinsufficiëntie toenemen en kan evolutie naar een totaal atrioventriculair blok ontstaan5.
Definitie van LBTB anno 2019
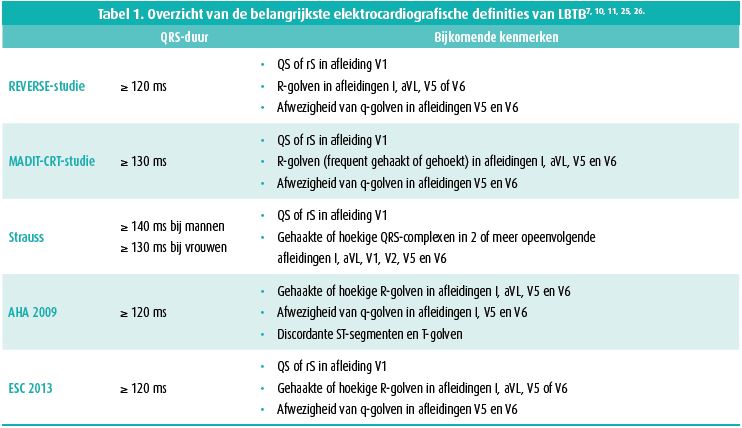
Het opstellen van gestandaardiseerde elektrocardiografische criteria voor LBTB liep niet van een leien dakje en blijft tot op heden controversieel. De eerste elektrocardiografische diagnose van LBTB bij patiënten werd beschreven door Carter in 1914. Door foutieve extrapolatie van een hondenmodel naar mensen wisselde hij echter linker- en rechterbundeltakblok (RBTB) om. Pas met de komst van de precordiale elektroden, twee decennia later, werd dit misverstand rechtgezet. De eerste definitie van LBTB werd opgesteld in 1941 door Wilson, en luidde als volgt: (i) QRS-duur ≥ 120 ms, (ii) rS in afleidingen V1 en V2, (iii) een grote gehaakte R-golf in afleidingen V5 en V6.
De keuze voor 120 ms was hoofdzakelijk gebaseerd op dieronderzoek en was bovendien pragmatisch vanwege de beperkte resolutie van de toenmalige elektrocardiografen7, 8. Deze definitie werd uiteindelijk internationaal bekrachtigd door de 'WHO/ISFC Task force criteria for conduction disturbances' in 19859.
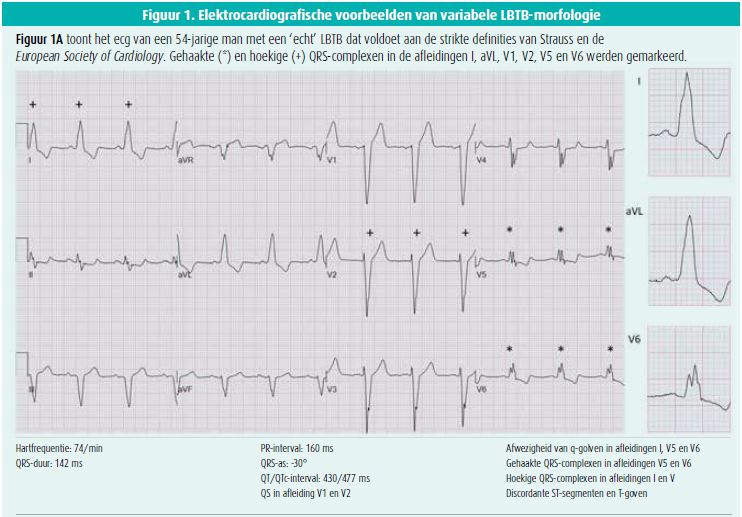
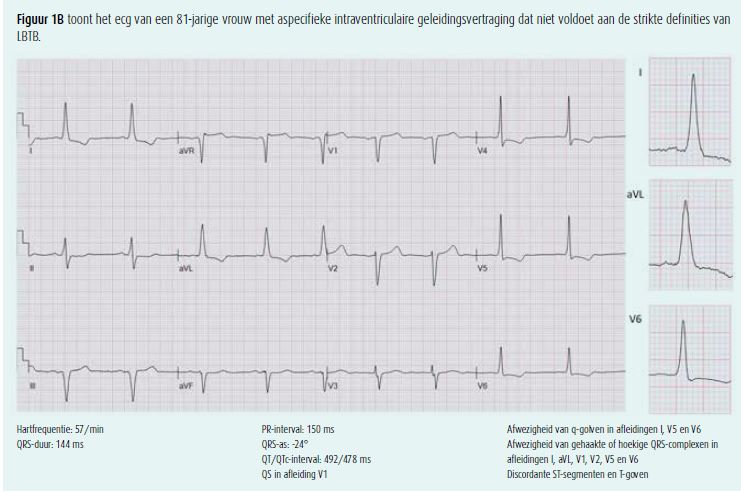
Sinds het CRT-tijdperk won de geleidingsstoornis progressief aan belangstelling en werden ook de criteria van LBTB geherdefinieerd. Meerdere subgroepanalyses van gerandomiseerde studies (REVERSE, MADIT-CRT, RAFT, COMPANION, CARE-HF) toonden in de laatste twee decennia aan dat het gunstige effect van CRT hoofdzakelijk bereikt werd in de hartfalenpopulatie met LBTB, en uitbleef bij patiënten met RBTB of aspecifieke intraventriculaire geleidingsvertraging10. Deze bevindingen lagen aan de basis voor een zoektocht naar betere elektrocardiografische LBTB-criteria om de selectie van CRT-kandidaten verder te optimaliseren. De uitgangspositie hierbij was dat patiënten met LBTB-morfologie en een succesvolle respons op CRT een 'echt' LBTB hebben, en patiënten die niet beantwoorden aan CRT eerder een aspecifieke intraventriculaire geleidingsvertraging vertonen met LBTB-achtige kenmerken. Vooral patiënten met linkerventrikelhypertrofie en linker anterior hemiblok behoren tot deze laatste groep en lopen het risico om bij het gebruik van een te brede LBTB-definitie foutief geclassificeerd te worden als LBTB. Strauss et al. suggereerden daarom het gebruik van een striktere definitie voor de identificatie van patiënten met 'echt' LBTB7. In hun definitie wordt een minimale geslachtsafhankelijke QRS-duur beschreven voor de diagnose van LBTB, en is de aanwezigheid van gehaakte of hoekige QRS-complexen in de laterale en/of septale afleidingen primordiaal (tabel 1, figuur 1). De gehaakte of hoekige R-golf in de laterale afleidingen is ondertussen een essentieel criterium geworden in de definities van de European Society of Cardiology en de American Heart Association10, 11 (tabel 1). Ook in de klinische praktijk blijkt een strikte definitie een belangrijke gunstige predictor van respons op CRT12-14.
LBTB: een proximaal geleidingsblok?
De linker bundeltak (LBT) ontstaat uit het verlengde van de bundel van His ter hoogte van de overgang van het rechter naar het niet-coronaire aortaklepblad. Vervolgens loopt de bundel subendocardiaal doorheen het membraneuze septum, om zich te splitsen in fasciculi die snelle activatie van het linker ventrikel mogelijk maken via een uitgebreid purkinjenetwerk15.
Theoretisch gezien kan een LBTB zijn oorsprong vinden op het hele traject van de linker bundel, zijn fasciculi en het daaruit voortvloeiende his-purkinjenetwerk. Een interessante populatie zijn de patiënten met de-novo-LBTB, ontstaan na chirurgische aortaklepvervanging en percutane aortaklepvervanging (TAVI, transkatheter- aortaklepimplantatie). In deze populaties is niet alleen het exacte ontstaansmoment van het LBTB gekend, maar ook de locatie van het blok. De incidentie van acuut de-novo-LBTB bedraagt ongeveer 4 % na chirurgische aortaklepvervanging en 5 tot 65 % na TAVI, afhankelijk van de studies en het type klep15, 16. In beide gevallen ontstaat het LBTB logischerwijze door een proximaal conductieblok ter hoogte van de overgang van de bundel van His naar de LBT15, 17. TAVI-geïnduceerd LBTB voldoet meestal aan de strikte LBTB-definities met een gehaakte of hoekige R-golf in de laterale afleidingen18, 19.
Bij de meeste patiënten kent het ontstaan van LBTB echter een meer sluipend verloop door langzame degeneratie en fibrosering van het conductiesysteem als gevolg van chronische evolutieve myocardiale aandoeningen (zoals ischemisch hartlijden, kleplijden en ventriculaire remodeling bij congestief hartfalen)15, 20. Er bestaat toenemende evidentie dat ook hier het LBTB proximaal ontstaat. Dat bewijs wordt geleverd door his-bundelpacing, waarbij het cardiale geleidingssysteem met een elektrode rechtstreeks ter hoogte van de bundel van His (en dus vrij proximaal in het conductiesysteem) gestimuleerd wordt. Niet alleen slaagt hisbundelpacing er meestal in om de QRS-duur van het LBTB te verkorten, maar ook de QRS-morfologie kan vaak genormaliseerd worden. Dat is uiteraard enkel mogelijk wanneer de LBT gestimuleerd kan worden distaal van het blok, wat erop wijst dat het blok een vrij proximale oorsprong ter hoogte van de bundel van His of de overgang naar de LBT moet hebben15.
Uit bovenstaande bevindingen kunnen we afleiden dat een gunstige CRT-respons hoofdzakelijk te verwachten valt bij patiënten met een 'echt' LBTB dat gekenmerkt wordt door een gehaakte of hoekige R-golf in de laterale afleidingen en een proximaal blok op de LBT. Distale geleidingsvertraging op de LBT zal daarentegen geen typisch LBTB-patroon vertonen op het ecg en bijgevolg ook minder beantwoorden aan CRT.
Bestaat LBTB-geïnduceerde cardiomyopathie?
LBTB veroorzaakt systolische disfunctie door een ongecoördineerde contractie van de ventrikels. Dit wordt geïllustreerd in figuur 2. In normale omstandigheden wordt het interventriculair septum geactiveerd van links naar rechts. Tijdens LBTB verandert de septale activatie: deze verloopt nu van rechts naar links. Hierdoor contraheert het septum vroegtijdig, nog voor de contractie van de vrije wand van het linker ventrikel op gang komt. Deze abnormale septale beweging bij LBTB veroorzaakt zo een shift van de laterale vrije wand van de linker ventrikel die hierdoor overstrekt, aangezien de aortaklep nog gesloten is (passieve stretch). Wanneer de laterale wand vervolgens laattijdig samentrekt als gevolg van de vertraagde linkerventrikelgeleiding door het LBTB, dan zal dit resulteren in een krachtige contractie van deze laterale vrije wand. Volgens het frank-starlingmechanisme zal een toegenomen preload ter hoogte van de vrije wand van de linker ventrikel immers resulteren in een toegenomen rek van de lokale cardiomyocyten die vervolgens krachtiger zullen contraheren om het slagvolume constant te houden. Hierdoor ondervindt het eerder gecontraheerde septum nu een shift terug naar rechts. Door deze paradoxale bewegingen van het septum en de vrije wand gaat tijdens iedere hartcontractie veel energie verloren (Engels: wasted energy), wat na verloop van tijd kan resulteren in hartfalen met een gedaalde ejectiefractie5.
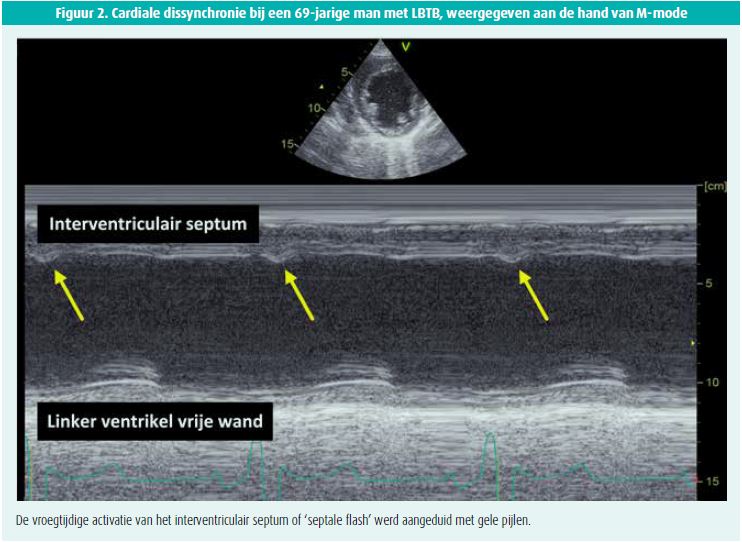
De snelle inwaartse beweging van het septum tijdens vroege systole voor opening van de aortaklep wordt in de literatuur 'septale flash' genoemd. Deze beweging kan bij patiënten met LBTB bestudeerd worden aan de hand van echocardiografie via klassieke 2D-echocardiografie, M-mode en op speckle tracking gebaseerde strainanalyse. Onderzoek toonde aan dat 'septale flash' de handtekening is van LBTB, maar de prevalentie verschilt sterk (verschillende studiepopulaties en LBTB-definities). Interessant is dat patiënten met 'septale flash' vaker voldoen aan de strikte LBTB-definities met een gehaakte of hoekige R-golf in de laterale afleidingen, en een betere respons vertonen op CRT21, 22.
Bovenstaande pathofysiologie maakt duidelijk hoe LBTB de primaire oorzaak kan zijn van cardiomyopathie bij patiënten zonder andere cardiale aanknopingspunten (Engels: LBBB-induced cardiomyopathy), maar eveneens kan bijdragen aan verdere linkerventrikeldisfunctie bij patiënten met voorafbestaand hartlijden23. Waarom niet alle patiënten met LBTB evolueren naar significante linkerventrikeldisfunctie of hartfalen, is tot op heden niet bekend. Vermoedelijk spelen genetische en hemodynamische factoren hier een rol1, 24.
Wat te onthouden?
LBTB is een onafhankelijke predictor van mortaliteit in de patiënt met hartfalen en onderliggend cardiaal lijden. LBTB zonder onderliggend cardiaal lijden is daarentegen zeldzaam en de prognostische betekenis ervan blijft onbekend. Jaarlijkse opvolging met echocardiografie is in dat geval aangewezen. De intrede van CRT en haar bewezen gunstige effecten bij patiënten met LBTB hebben gezorgd voor striktere LBTB-criteria. De nieuwe definities vereisen de aanwezigheid van een gehaakte of hoekige R-golf in de laterale afleidingen om te kunnen spreken van 'echt' LBTB. Een strikte definitie van LBTB blijkt niet alleen een belangrijke predictor van gunstige respons op CRT, maar ook de handtekening van het proximale karakter van het geleidingsblok op de LBT en een merker voor de aanwezigheid van mechanische dissynchronie in de vorm van 'septale flash' op echocardiografie.
Referenties
- Surkova, E., Badano, L.P., Bellu, R., Aruta, P., Sambugaro, F., Romeo G, et al. Left bundle branch block: from cardiac mechanics to clinical and diagnostic challenges. Europace, 2017, 19 (8), 1251-1271.
- Francia, P., Balla, C., Paneni, F., Volpe, M. Left bundle-branch block-pathophysiology, prognosis, and clinical management. Clin Cardiol, 2007, 30 (3), 110-115.
- Vernooy, K., Verbeek, X.A., Peschar, M., Crijns, H.J., Arts, T., Cornelussen, R.N., et al. Left bundle branch block induces ventricular remodelling and functional septal hypoperfusion. Eur Heart J, 2005, 26 (1), 91-98.
- Breithardt, G., Breithardt, O.A. Left bundle branch block, an old-new entity. J Cardiovasc Transl Res, 2012, 5 (2), 107-116.
- Smiseth, O.A., Aalen, J.M. Mechanism of harm from left bundle branch block. Trends Cardiovasc Med, 2018. https://doi.org/10.1016/j.tcm.2018.10.012.
- Auffret, V., Martins, R.P., Daubert, C., Leclercq, C., Le Breton, H., Mabo, P., et al. Idiopathic/ Iatrogenic Left Bundle Branch Block-Induced Reversible Left Ventricle Dysfunction: JACC State-of-the-Art Review. J Am Coll Cardiol, 2018, 72 (24), 3177-3188.
- Strauss, D.G., Selvester, R.H., Wagner, G.S. Defining left bundle branch block in the era of cardiac resynchronization therapy. Am J Cardiol, 2011, 107 (6), 927-934.
- Kanawati, J., Sy, R.W. Contemporary Review of Left Bundle Branch Block in the Failing Heart - Pathogenesis, Prognosis, and Therapy. Heart Lung Circ, 2018, 27 (3), 291-300.
- Willems, J.L., Robles de Medina, E.O., Bernard, R., Coumel, P., Fisch, C., Krikler, D., et al. Criteria for intraventricular conduction disturbances and pre-excitation. World Health Organizational/ International Society and Federation for Cardiology Task Force Ad Hoc. J Am Coll Cardiol, 1985, 5 (6), 1261-1275.
- Brignole, M., Auricchio, A., Baron-Esquivias, G., Bordachar, P., Boriani, G., Breithardt, O.A., et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace, 2013, 15 (8), 1070-1118.
- Surawicz, B., Childers, R., Deal, B.J., Gettes, L.S., Bailey, J.J., Gorgels, A., et al. AHA/ACCF/ HRS recommendations for the standardization and interpretation of the electrocardiogram: part III: intraventricular conduction disturbances: a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society: endorsed by the International Society for Computerized Electrocardiology. Circulation, 2009, 119 (10), e235-40.
- Mascioli, G., Padeletti, L., Sassone, B., Zecchin, M., Lucca, E., Sacchi, S., et al. Electrocardiographic criteria of true left bundle branch block: a simple sign to predict a better clinical and instrumental response to CRT. Pacing Clin Electrophysiol, 2012, 35 (8), 927-934.
- Tian, Y., Zhang, P., Li, X., Gao, Y., Zhu, T., Wang, L., et al. True complete left bundle branch block morphology strongly predicts good response to cardiac resynchronization therapy. Europace, 2013, 15 (10), 1499-1506.
- Caputo, M.L., van Stipdonk, A., Illner, A., D'Ambrosio, G., Regoli, F., Conte, G., et al. The definition of left bundle branch block influences the response to cardiac resynchronization therapy. Int J Cardiol, 2018, 269, 165-169.
- Nguyen, U.C., Verzaal, N.J., van Nieuwenhoven, F.A., Vernooy, K., Prinzen, F.W. Pathobiology of cardiac dyssynchrony and resynchronization therapy. Europace, 2018, 20 (12), 1898-1909.
- Poels, T.T., Houthuizen, P., Van Garsse, L.A., Maessen, J.G., de Jaegere, P., Prinzen, F.W. Transcatheter aortic valve implantation-induced left bundle branch block: causes and consequences. J Cardiovasc Transl Res, 2014, 7 (4), 395-405.
- Massoullie, G., Bordachar, P., Ellenbogen, K.A., Souteyrand, G., Jean, F., Combaret, N., et al. New-Onset Left Bundle Branch Block Induced by Transcutaneous Aortic Valve Implantation. Am J Cardiol, 2016, 117 (5), 867-873.
- Klaeboe, L.G., Brekke, P.H., Lie, O.H., Aaberge, L., Haugaa, K.H., Edvardsen, T. Classical mechanical dyssynchrony is rare in transcatheter aortic valve implantation-induced left bundle branch block. Eur Heart J Cardiovasc Imaging, 2018, https://doi.org/10.1093/ ehjci/jey127.
- Sundh, F., Simlund, J., Harrison, J.K., Hughes, G.C., Vavalle, J., Maynard, C., et al. Incidence of strict versus nonstrict left bundle branch block after transcatheter aortic valve replacement. Am Heart J, 2015, 169 (3), 438-444.
- Neeland, I.J., Kontos, M.C., de Lemos, J.A. Evolving considerations in the management of patients with left bundle branch block and suspected myocardial infarction. J Am Coll Cardiol, 2012, 60 (2), 96-105.
- Corteville, B., De Pooter, J., De Backer, T., El Haddad, M., Stroobandt, R., Timmermans, F. The electrocardiographic characteristics of septal flash in patients with left bundle branch block. Europace, 2017, 19 (1), 103-109.
- Stankovic, I., Prinz, C., Ciarka, A., Daraban, A.M., Kotrc, M., Aarones, M., et al. Relationship of visually assessed apical rocking and septal flash to response and long-term survival following cardiac resynchronization therapy (PREDICT-CRT). Eur Heart J Cardiovasc Imaging, 2016, 17 (3), 262-269.
- Vaillant, C., Martins, R.P., Donal, E., Leclercq, C., Thebault, C., Behar, N., et al. Resolution of left bundle branch block-induced cardiomyopathy by cardiac resynchronization therapy. J Am Coll Cardiol, 2013, 61 (10), 1089-1095.
- Aalen, J., Storsten, P., Remme, E.W., Sirnes, P.A., Gjesdal, O., Larsen, C.K., et al. Afterload Hypersensitivity in Patients With Left Bundle Branch Block. JACC Cardiovascular imaging, 2018, https://doi.org/10.1016/j. jcmg.2017.11.025.
- Gold, M.R., Thebault, C., Linde, C., Abraham, W.T., Gerritse, B., Ghio, S., et al. Effect of QRS duration and morphology on cardiac resynchronization therapy outcomes in mild heart failure: results from the Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction (REVERSE) study. Circulation, 2012, 126 (7), 822-829.
- Zareba, W., Klein, H., Cygankiewicz, I., Hall, W.J., McNitt, S., Brown, M., et al. Effectiveness of Cardiac Resynchronization Therapy by QRS Morphology in the Multicenter Automatic Defibrillator Implantation Trial-Cardiac Resynchronization Therapy (MADIT-CRT). Circulation, 2011, 123 (10), 1061-1072.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.