à l'ère du traitement de resynchronisation cardiaque, le bloc de branche gauche a évolué d'une découverte purement électrocardiographique à une entité cardiaque à part entière.
Introduction
La présence d'un bloc de branche gauche (BBG) à l'électrocardiogramme (ecg) ne peut qu'inquiéter le clinicien, étant donné l'association avec une mortalité cardiovasculaire élevée, la mort subite cardiaque et l'insuffisance cardiaque. Le diagnostic électrocardiographique d'un BBG nécessitera dès lors souvent une mise au point complémentaire et un suivi cardiaque ultérieur1. Le BBG a été décrit pour la première fois il y a plus d'un siècle, comme un diagnostic électrocardiographique. Ces dernières décennies, de nouvelles notions nous ont amenés à ne plus considérer le BBG comme une découverte purement électrocardiographique, mais plutôt comme une entité cardiaque à part entière, ayant une physiopathologie, un diagnostic et une approche thérapeutique propres. Cet article évoque les principales facettes de ce trouble de conduction, sur la base de notions récentes issues d'études scientifiques expérimentales et cliniques.
épidémiologie, étiologie et pronostic
La prévalence du BBG dans la population générale est faible (< 1 %) et elle augmente avec l'âge, passant de 0,5 % à 50 ans à 5 % à 80 ans2. étant donné que le développement du BBG passe le plus souvent inaperçu, on sait peu de chose à propos de son étiologie et du mécanisme d'apparition précis. Des études longitudinales nous ont appris que le BBG est associé à l'hypertension artérielle, aux maladies coronariennes, aux valvulopathies, aux myocardites, aux cardiomyopathies et à l'hypertrophie ventriculaire gauche1. Pendant des décennies, on a admis que le BBG était simplement une signature électrocardiographique de ces affections cardiaques sous-jacentes. Toutefois, tant les études observationnelles que des expériences animales ont montré que la présence d'un BBG a une influence directe et indépendante sur la fonction ventriculaire gauche, et qu'il peut donc en soi être à l'origine d'une insuffisance cardiaque à fraction d'éjection réduite. De ce fait, le BBG constitue en soi un élément prédictif indépendant de mortalité dans cette population de patients. Ce dernier point est par ailleurs confirmé par l'effet bénéfique d'un traitement de resynchronisation cardiaque (TRC) efficace sur la mortalité, chez un patient souffrant d'insuffisance cardiaque et d'un BBG3-5. La présence d'un BBG sans affection cardiaque sous-jacente est rare (< 0,1 % de la population totale)1. Le risque d'insuffisance cardiaque et de mortalité chez des individus apparemment en bonne santé, ayant un nouveau diagnostic de BBG, est moins bien documenté5. Ceci est dû à la prévalence très faible dans cette population et au développement à bas bruit, expliquant que le BBG est souvent découvert fortuitement. Dans ce cas, un suivi annuel de ces patients, avec échocardiographie, est justifié5, 6. Outre une influence négative sur la fonction systolique et diastolique des deux ventricules, un BBG peut majorer une insuffisance mitrale et provoquer une évolution vers un bloc auriculo-ventriculaire complet5.
La définition du BBG en 2019
L'élaboration de critères électrocardiographiques standardisés pour le BBG s'avéra tout sauf simple, et des controverses persistent encore à l'heure actuelle. Le premier diagnostic électrocardiographique d'un BBG chez des patients a été décrit par Carter en 1914. Toutefois, en raison d'extrapolations erronées d'un modèle canin à l'homme, il a 'permuté' les blocs de branche gauche (BBG) et droit (BBD). Ce n'est qu'avec l'arrivée des électrodes précordiales, vingt ans plus tard, que cette méprise a été corrigée. La première définition du BBG, formulée en 1941 par Wilson, était la suivante: (i) durée du QRS ≥ 120 ms, (ii) rS en dérivations V1 et V2, (iii) une grande onde R crochetée en dérivations V5 et V6.
Le choix de la durée de 120 ms était essentiellement basé sur des expérimentations animales et il était en outre pragmatique, en raison de la résolution limitée des appareils d'électrocardiographie de l'époque7, 8. Cette définition a finalement été validée au niveau international par le 'WHO/ISFC Task force criteria for conduction disturbances' en 19859.
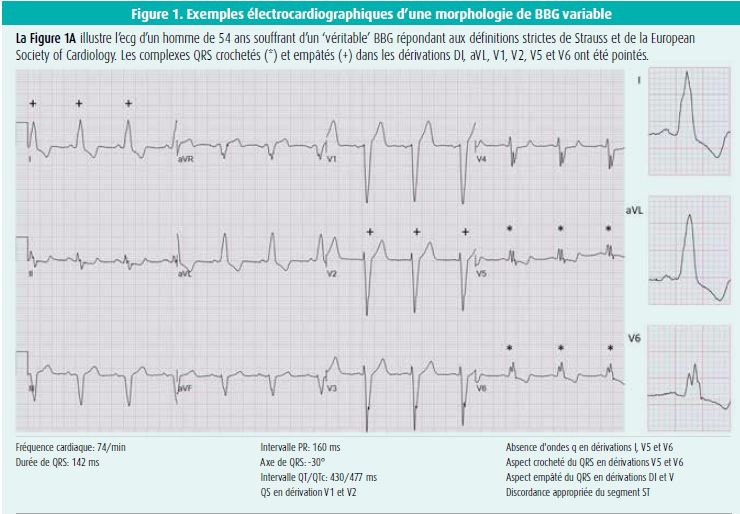
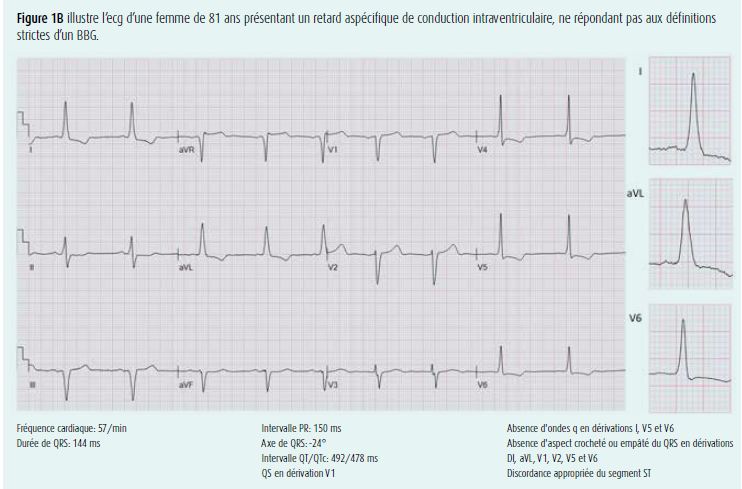
Depuis l'avènement du TRC, ce trouble de conduction a progressivement suscité un regain d'intérêt, et les critères du BBG ont également été redéfinis. Plusieurs analyses de sous-groupes d'études randomisées (REVERSE, MADIT-CRT, RAFT, COMPANION, CARE-HF) ont montré, ces deux dernières décennies, que le TRC était essentiellement efficace dans la population de patients souffrant d'insuffisance cardiaque et d'un BBG, et non chez les patients souffrant d'un BBD ou d'un retard de conduction intraventriculaire aspécifique10. Ces observations ont été à la base de la recherche de meilleurs critères électrocardiographiques pour le BBG, afin d'optimiser la sélection des candidats au TRC. à cet égard, le postulat de départ était que les patients ayant une morphologie de BBG et une réponse favorable au TRC ont un 'véritable' BBG, et que les patients qui ne répondent pas au TRC ont plutôt un retard de conduction intraventriculaire aspécifique avec des caractéristiques 'BBG-like'. Ce sont surtout les patients souffrant d'hypertrophie ventriculaire gauche et d'un hémibloc antérieur gauche qui font partie de ce dernier groupe, et qui courent un risque d'être classés - à tort - comme ayant un BBG, si on utilise une définition trop large du BBG. Pour cette raison, Strauss et al. ont suggéré l'utilisation d'une définition plus stricte pour l'identification des patients ayant un 'véritable' BBG7. Dans leur définition, on décrit une durée minimale des QRS - dépendant du sexe - pour parler de BBG, et la présence de complexes QRS crochetés ou empâtés en dérivations latérales et/ou septales est primordiale (tableau 1, figure 1). L'onde R crochetée ou empâtée dans les dérivations latérales est entre-temps devenue un critère essentiel dans les définitions de la European Society of Cardiology et de l'American Heart Association10, 11 (tableau 1). En pratique clinique également, une définition stricte constitue un élément prédictif important de réponse favorable au TRC12-14.

Le BBG: un bloc de conduction proximal?
La branche gauche (BG) prend naissance à hauteur du prolongement du faisceau de His, au niveau de la jonction entre le feuillet valvulaire aortique droit et non-coronaire. Par la suite, le faisceau circule, sous l'endocarde, à travers le septum membraneux, pour se scinder en rameaux qui permettent l'activation rapide du ventricule gauche via un vaste réseau de Purkinje15.
Théoriquement, un BBG peut prendre naissance au niveau de l'entièreté du trajet de la branche gauche, des rameaux ou du réseau de His-Purkinje qui en dérive. Les patients présentant un BBG de novo, apparu après un remplacement chirurgical de la valve aortique ou un TAVI (implantation transcathéter d'une valve aortique), constituent une population intéressante. Chez ces patients, on connaît non seulement le moment exact d'apparition du BBG, mais aussi la localisation du bloc. L'incidence du BBG de novo aigu atteint environ 4 % après un remplacement chirurgical de la valve aortique et 5 à 65 % après un TAVI, en fonction des études et du type de valve15, 16. Dans les deux cas, le BBG résulte logiquement d'un bloc de conduction proximal au niveau de la jonction entre le faisceau de His et la BG15, 17. Un BBG induit par un TAVI répond le plus souvent aux définitions strictes du BBG, avec une onde R crochetée ou empâtée dans les dérivations latérales18, 19.
Chez la plupart des patients, l'apparition du BBG est toutefois plus insidieuse, suite à une lente dégénérescence et à une fibrose du système de conduction, résultant d'affections myocardiques évolutives chroniques (telles que cardiopathies ischémiques, valvulopathies et remodelage ventriculaire en cas d'insuffisance cardiaque congestive)15, 20. Ici, des preuves croissantes indiquent que le BBG apparaît également au niveau proximal. Ces preuves proviennent du pacing du faisceau de His, lors duquel le système de conduction cardiaque est directement stimulé au niveau du faisceau de His, au moyen d'une électrode (et donc assez proximalement, dans le système de conduction). Non seulement le pacing du faisceau de His parvient généralement à raccourcir la durée des QRS du BBG, mais la morphologie des QRS peut aussi souvent être normalisée. Il va de soi que ceci n'est possible que lorsque la BG peut être stimulée distalement par rapport au bloc, ce qui indique que le bloc doit avoir une origine assez proximale au niveau du faisceau de His ou de la jonction avec la BG15.
Les observations ci-dessus nous permettent de déduire qu'on peut essentiellement escompter une réponse favorable au TRC chez les patients présentant un 'véritable' BBG, caractérisé par une onde R crochetée ou empâtée dans les dérivations latérales et un bloc proximal sur la BG. En revanche, un retard de conduction distal sur la BG n'entraînera pas l'aspect typique du BBG à l'ecg, et répondra par conséquent moins bien au TRC.
Existe-t-il une cardiomyopathie induite par un BBG?
Un BBG provoque une dysfonction systolique suite à une contraction incoordonnée des ventricules. Ceci est illustré à la figure 2. Dans des circonstances normales, le septum interventriculaire est activé de gauche à droite. Pendant un BBG, l'activation septale change: elle se fait maintenant de droite à gauche. De ce fait, le septum se contracte précocement, avant même que la contraction de la paroi libre du ventricule gauche ne commence. Ce mouvement septal anormal en cas de BBG provoque ainsi un déplacement de la paroi latérale libre du ventricule gauche, qui est ainsi trop étirée, puisque la valve aortique est encore fermée (étirement passif). Lorsque la paroi latérale se contracte ensuite tardivement, suite au retard de conduction ventriculaire gauche à travers le BBG, il en résultera une forte contraction de cette paroi latérale libre. Selon le mécanisme de Frank-Starling, une précharge accrue au niveau de la paroi libre du ventricule gauche entraînera en effet une augmentation de l'extensibilité des cardiomyocytes locaux, qui se contracteront par la suite plus vigoureusement pour maintenir le débit systolique constant. De ce fait, le septum qui s'était précédemment contracté subit maintenant un déplacement vers la droite. Ces mouvements paradoxaux du septum et de la paroi libre provoquent une importante perte d'énergie à chaque contraction cardiaque (en anglais: wasted energy), ce qui, au fil du temps, peut entraîner une insuffisance cardiaque à fraction d'éjection réduite5.
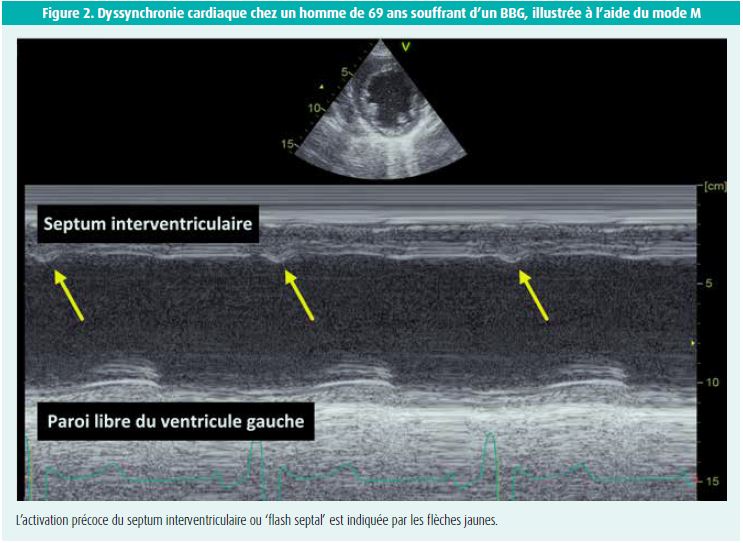
Le mouvement rapide du septum vers l'intérieur, au début de la systole, avant l'ouverture de la valve aortique, est appelé 'flash septal' dans la littérature. Ce mouvement peut être étudié chez les patients atteints d'un BBG au moyen de l'échocardiographie, via l'échocardiographie 2D classique, le mode M et l'analyse du strain speckle tracking. Les études ont montré que le 'flash septal' est la signature du BBG, mais la prévalence varie considérablement (différentes populations d'étude et définitions du BBG). Il est intéressant de noter que les patients présentant un 'flash septal' répondent plus souvent aux définitions strictes du BBG avec une onde R crochetée ou empâtée dans les dérivations latérales, et qu'ils présentent une meilleure réponse au TRC21, 22.
La physiopathologie ci-dessus illustre clairement comment un BBG peut être la cause primaire d'une cardiomyopathie chez les patients n'ayant pas d'autres points de départ cardiaques potentiels (en anglais: LBBB-induced cardiomyopathy), mais aussi comment il peut contribuer à la progression d'une dysfonction ventriculaire gauche chez les patients souffrant d'une cardiopathie préexistante23. à ce jour, on ne sait pas encore pourquoi tous les patients atteints d'un BBG n'évoluent pas vers une dysfonction ventriculaire gauche significative ou de l'insuffisance cardiaque. Il est vraisemblable que des facteurs génétiques et hémodynamiques jouent un rôle ici1, 24.
Que faut-il retenir?
Un BBG constitue un élément prédictif indépendant de mortalité chez les patients atteints d'insuffisance cardiaque et d'une cardiopathie sous-jacente. En revanche, un BBG sans affection cardiaque sous-jacente est rare, et sa signification pronostique reste inconnue. Dans ce cas, un suivi annuel avec échocardiographie est recommandé. L'introduction du TRC et ses effets bénéfiques prouvés chez les patients présentant un BBG ont donné lieu à des critères plus stricts pour parler de BBG. Les nouvelles définitions exigent la présence d'une onde R crochetée ou empâtée dans les dérivations latérales pour pouvoir parler de 'véritable' BBG. Une définition stricte du BBG est non seulement un élément prédictif important de réponse favorable au TRC, mais c'est aussi la signature du caractère proximal du bloc de conduction sur la BG et un marqueur de la présence d'une dyssynchronie mécanique sous la forme de 'flash septal' à l'échocardiographie.
Références
- Surkova, E., Badano, L.P., Bellu, R., Aruta, P., Sambugaro, F., Romeo G, et al. Left bundle branch block: from cardiac mechanics to clinical and diagnostic challenges. Europace, 2017, 19 (8), 1251-1271.
- Francia, P., Balla, C., Paneni, F., Volpe, M. Left bundle-branch block-pathophysiology, prognosis, and clinical management. Clin Cardiol, 2007, 30 (3), 110-115.
- Vernooy, K., Verbeek, X.A., Peschar, M., Crijns, H.J., Arts, T., Cornelussen, R.N., et al. Left bundle branch block induces ventricular remodelling and functional septal hypoperfusion. Eur Heart J, 2005, 26 (1), 91-98.
- Breithardt, G., Breithardt, O.A. Left bundle branch block, an old-new entity. J Cardiovasc Transl Res, 2012, 5 (2), 107-116.
- Smiseth, O.A., Aalen, J.M. Mechanism of harm from left bundle branch block. Trends Cardiovasc Med, 2018. https://doi.org/10.1016/j.tcm.2018.10.012.
- Auffret, V., Martins, R.P., Daubert, C., Leclercq, C., Le Breton, H., Mabo, P., et al. Idiopathic/ Iatrogenic Left Bundle Branch Block-Induced Reversible Left Ventricle Dysfunction: JACC State-of-the-Art Review. J Am Coll Cardiol, 2018, 72 (24), 3177-3188.
- Strauss, D.G., Selvester, R.H., Wagner, G.S. Defining left bundle branch block in the era of cardiac resynchronization therapy. Am J Cardiol, 2011, 107 (6), 927-934.
- Kanawati, J., Sy, R.W. Contemporary Review of Left Bundle Branch Block in the Failing Heart - Pathogenesis, Prognosis, and Therapy. Heart Lung Circ, 2018, 27 (3), 291-300.
- Willems, J.L., Robles de Medina, E.O., Bernard, R., Coumel, P., Fisch, C., Krikler, D., et al. Criteria for intraventricular conduction disturbances and pre-excitation. World Health Organizational/ International Society and Federation for Cardiology Task Force Ad Hoc. J Am Coll Cardiol, 1985, 5 (6), 1261-1275.
- Brignole, M., Auricchio, A., Baron-Esquivias, G., Bordachar, P., Boriani, G., Breithardt, O.A., et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace, 2013, 15 (8), 1070-1118.
- Surawicz, B., Childers, R., Deal, B.J., Gettes, L.S., Bailey, J.J., Gorgels, A., et al. AHA/ACCF/ HRS recommendations for the standardization and interpretation of the electrocardiogram: part III: intraventricular conduction disturbances: a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society: endorsed by the International Society for Computerized Electrocardiology. Circulation, 2009, 119 (10), e235-40.
- Mascioli, G., Padeletti, L., Sassone, B., Zecchin, M., Lucca, E., Sacchi, S., et al. Electrocardiographic criteria of true left bundle branch block: a simple sign to predict a better clinical and instrumental response to CRT. Pacing Clin Electrophysiol, 2012, 35 (8), 927-934.
- Tian, Y., Zhang, P., Li, X., Gao, Y., Zhu, T., Wang, L., et al. True complete left bundle branch block morphology strongly predicts good response to cardiac resynchronization therapy. Europace, 2013, 15 (10), 1499-1506.
- Caputo, M.L., van Stipdonk, A., Illner, A., D'Ambrosio, G., Regoli, F., Conte, G., et al. The definition of left bundle branch block influences the response to cardiac resynchronization therapy. Int J Cardiol, 2018, 269, 165-169.
- Nguyen, U.C., Verzaal, N.J., van Nieuwenhoven, F.A., Vernooy, K., Prinzen, F.W. Pathobiology of cardiac dyssynchrony and resynchronization therapy. Europace, 2018, 20 (12), 1898-1909.
- Poels, T.T., Houthuizen, P., Van Garsse, L.A., Maessen, J.G., de Jaegere, P., Prinzen, F.W. Transcatheter aortic valve implantation-induced left bundle branch block: causes and consequences. J Cardiovasc Transl Res, 2014, 7 (4), 395-405.
- Massoullie, G., Bordachar, P., Ellenbogen, K.A., Souteyrand, G., Jean, F., Combaret, N., et al. New-Onset Left Bundle Branch Block Induced by Transcutaneous Aortic Valve Implantation. Am J Cardiol, 2016, 117 (5), 867-873.
- Klaeboe, L.G., Brekke, P.H., Lie, O.H., Aaberge, L., Haugaa, K.H., Edvardsen, T. Classical mechanical dyssynchrony is rare in transcatheter aortic valve implantation-induced left bundle branch block. Eur Heart J Cardiovasc Imaging, 2018, https://doi.org/10.1093/ ehjci/jey127.
- Sundh, F., Simlund, J., Harrison, J.K., Hughes, G.C., Vavalle, J., Maynard, C., et al. Incidence of strict versus nonstrict left bundle branch block after transcatheter aortic valve replacement. Am Heart J, 2015, 169 (3), 438-444.
- Neeland, I.J., Kontos, M.C., de Lemos, J.A. Evolving considerations in the management of patients with left bundle branch block and suspected myocardial infarction. J Am Coll Cardiol, 2012, 60 (2), 96-105.
- Corteville, B., De Pooter, J., De Backer, T., El Haddad, M., Stroobandt, R., Timmermans, F. The electrocardiographic characteristics of septal flash in patients with left bundle branch block. Europace, 2017, 19 (1), 103-109.
- Stankovic, I., Prinz, C., Ciarka, A., Daraban, A.M., Kotrc, M., Aarones, M., et al. Relationship of visually assessed apical rocking and septal flash to response and long-term survival following cardiac resynchronization therapy (PREDICT-CRT). Eur Heart J Cardiovasc Imaging, 2016, 17 (3), 262-269.
- Vaillant, C., Martins, R.P., Donal, E., Leclercq, C., Thebault, C., Behar, N., et al. Resolution of left bundle branch block-induced cardiomyopathy by cardiac resynchronization therapy. J Am Coll Cardiol, 2013, 61 (10), 1089-1095.
- Aalen, J., Storsten, P., Remme, E.W., Sirnes, P.A., Gjesdal, O., Larsen, C.K., et al. Afterload Hypersensitivity in Patients With Left Bundle Branch Block. JACC Cardiovascular imaging, 2018, https://doi.org/10.1016/j. jcmg.2017.11.025.
- Gold, M.R., Thebault, C., Linde, C., Abraham, W.T., Gerritse, B., Ghio, S., et al. Effect of QRS duration and morphology on cardiac resynchronization therapy outcomes in mild heart failure: results from the Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction (REVERSE) study. Circulation, 2012, 126 (7), 822-829.
- Zareba, W., Klein, H., Cygankiewicz, I., Hall, W.J., McNitt, S., Brown, M., et al. Effectiveness of Cardiac Resynchronization Therapy by QRS Morphology in the Multicenter Automatic Defibrillator Implantation Trial-Cardiac Resynchronization Therapy (MADIT-CRT). Circulation, 2011, 123 (10), 1061-1072.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.