
Inleiding
Infectieuze endocarditis als gevolg van een implantaat in het hart (CDRIE: Cardiac Device-Related Infective Endocarditis) is zeldzaam, maar de incidentie ervan stijgt gestaag parallel met het aantal pacemakers (PM) en implanteerbare defibrillatoren (ICD: Implantable Cardioverter Defibrillator) die de laatste jaren ingeplant zijn.1 Zonder behandeling (antibiotica en verwijdering van het implantaat en de elektroden) is de sterfte hoog: tot 40 % na 1 jaar. De diagnose moet dan ook snel gesteld worden (major en minor criteria van Duke), wat niet altijd gemakkelijk is gezien de zeer uiteenlopende klinische presentatie en de zwakte van bepaalde criteria. In meer dan 30 % van de gevallen geeft een transoesofageale echocardiografie geen uitsluitsel en in 30 % van de gevallen zijn de hemoculturen negatief.
De laatste richtlijnen voor infectieuze endocarditis van de Europese Vereniging voor Cardiologie (ESC 2015) benadrukken het belang van een positronemissietomografie (PET-scan of PET-CT-scan). Een positieve PET-scan is een belangrijk criterium.1 Als de klassieke beeldvormingsonderzoeken (transoesofageale echocardiografie of CT-scan) geen zekerheidsdiagnose geven, is de rendabiliteit van een PET-scan uitstekend.
Wij presenteren een recente klinische casus waarbij de zekerheidsdiagnose van endocarditis van een ICD enkel gesteld kon worden via een PET-CT-scan. We herinneren aan het belang van dat onderzoek bij het diagnosticeren van een CDRIE. Het onderzoek kan echter fout-positieve en fout-negatieve uitkomsten geven.2-9 Die diagnose heeft belangrijke therapeutische implicaties: verwijdering van het materiaal, langdurige behandeling met antibiotica, langdurig ziekenhuisverblijf, plaatsing van een nieuw implantaat …
Gevalsbeschrijving
Een 55-jarige man bij wie een maand geleden een ICD ingeplant werd wegens een blok boven de bundel van His en syncope op ventrikeltachycardie wordt op de Dienst cardiologie opgenomen na een verblijf op de Intensive care wegens MSSA-sepsis van onbekende oorsprong. De patiënt heeft een voorgeschiedenis van ischemisch hartlijden (oud infarct), episoden van paroxismale AF, waarvoor hij behandeld wordt met rivaroxaban (Xarelto®), en risicofactoren (roken en type 2-diabetes).
Bij opname klaagt de patiënt over veralgemeende zwakte en een sterk functioneel onvermogen. Hij heeft niet-inspanningsgebonden pijn in de linkerborstkaswand, die niet uitstraalt. Sinds zijn opname op de Intensive care klaagt hij over veeleer mechanische hoge rugpijn.
De patiënt ziet er bleek uit, zweet en vertoont een lichte polypneu. Hij heeft geen koorts. Zijn pols is regelmatig, 120/min. Hartauscultatie toont geen bijzonderheden. Bij longauscultatie horen we basale crepitaties links en rechts. Druk op de wervelkolom doet geen pijn. De streek waar de defibrillator zit, is niet gevoelig voor palpatie en vertoont geen erytheem of tekenen van infectie. De huid van de extremiteiten ziet er normaal uit.
We voeren de volgende aanvullende onderzoeken uit:
- Hemoculturen: positief op MSSA bij opname op de intensive care en negatief na 3 dagen toediening van antibiotica. De frequentste verwekker van een vroege infectie van een CIED (Cardiac Implantable Electronic Device) is inderdaad Staphylococcus aureus.
- Transoesofageale echocardiografie: focale verdikking van 5x5 mm van de pacemakerelektrode in het rechter auriculum.
- CT-scan van thorax en abdomen: geen collectie rond de pacemakerdoos, echter onder voorbehoud, want veel artefacten als gevolg van het metaal. Een vijftiental verdichtingen verspreid in beide longen. Geen tekenen van spondylodiscitis.
- PET-CT-scan: meerdere haarden compatibel met infectieuze letsels:
- rond de doos van de defibrillator en enkel in het subclaviculaire traject van de ventrikelelektrode (figuur 1-2);
- vermoeden van spondylodiscitis C5-C6 en C6-C7;
- meerdere haarden in beide longen.
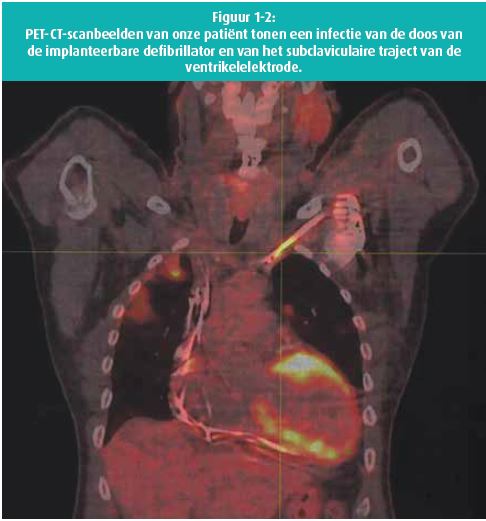
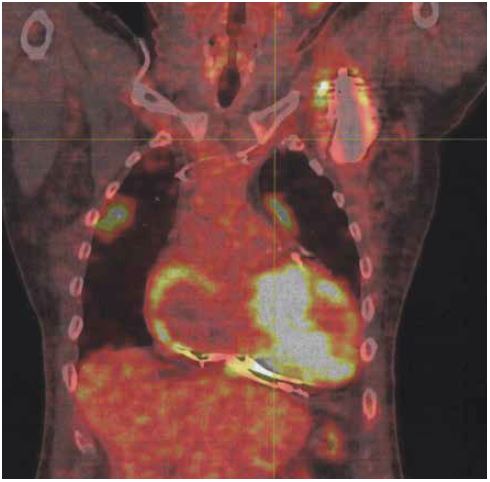
De longletsels die we bij onze patiënt waargenomen hebben, zijn een frequente complicatie van infectie van een CIED. Dergelijke letsels op een PET-CT-scan wijzen sterk op een infectie en verhogen de sensitiviteit van het onderzoek.
Op grond van dat onderzoek stellen we dus de diagnose van CDRIE, waarvoor een totale curatieve behandeling uitgevoerd wordt. Na verwijdering van de defibrillator en starten van een lange behandeling met antibiotica, in casu flucloxacilline (Floxapen®) en rifampicine (Rifadine®), evolueren de kliniek en de laboratoriumresultaten in gunstige zin. Vervolgens wordt een subcutane defibrillator (S-ICD) geplaatst. De evolutie na 5 maanden is bevredigend … en de patiënt rookt zelfs weer.
Discussie
Infectieuze endocarditis als gevolg van een CIED is zeldzaam, maar de incidentie ervan stijgt voortdurend en wordt nu geraamd op 0,5 % tot 5 % van de gevallen, parallel met het aantal pacemakers en ICD's dat ingeplant wordt. Een infectie van het implantaat wijst echter niet altijd op endocarditis (CDRIE). Een endocarditis is evenwel de zwaarste complicatie van zo'n infectie. Als de infectie beperkt blijft tot de zone van implantatie, spreken we van LDI (Local Device Infection). In meer dan 70 % van de gevallen worden late vormen veroorzaakt door Staphylococcus epidermidis en vroege vormen door Staphylococcus aureus.
De diagnose is vaak duidelijk op grond van de major en minor criteria van Duke: hemoculturen positief op een stafylokok, zichtbaar subcutaan abces op de plaats van inplanting, vegetaties op de elektroden bij transoesofageale echocardiografie. Soms is de diagnose echter minder duidelijk, meer bepaald bij de evaluatie van koorts van onbekende oorsprong bij een patiënt met een PM of een ICD, bij wie de transoesofageale echocardiografie weinig contributief is, de hemoculturen negatief zijn door inname van antibiotica … of gewoonweg bij wie de presentatie atypisch is.
Risicofactoren voor CDRIE zijn patiëntgebonden risicofactoren (chronische nierinsufficiëntie, gebruik van corticoïden, kanker, hartfalen, diabetes, inname van anticoagulantia) en risicofactoren volgens de procedure (revisie of vervanging, ervaring van de arts, duur van de procedure, geen profylactische toediening van antibiotica, tijdelijke pacemaker tijdens de procedure). De twee diagnostische onderzoeken die klassiek aanbevolen worden (klasse IC) in de richtlijnen van de ESC 2015, zijn hemoculturen en een transoesofageale echocardiografie. Die zijn echter in 30 % van de gevallen weinig contributief. Bij transoesofageale echocardiografie kun je het extracardiale gedeelte van de elektroden niet in beeld brengen en kun je evenmin een LDI diagnosticeren. In geval van een LDI, dus een extracardiale infectie, is de behandeling heel anders en worden de elektroden niet verwijderd.1 Bij transoesofageale echocardiografie kun je niet altijd een echte vegetatie onderscheiden van een trombus of een mobiel filament op een elektrode. De incidentie van filamenten wordt geraamd op 10-15 % bij transthoracale echocardiografie en op 30 % bij intracardiale echografie uitgevoerd tijdens een ablatieprocedure. Dat kan resulteren in een verkeerde behandeling. Als enkel de PM/ICD geïnfecteerd is, zullen de hemoculturen negatief zijn.
In dat kader is een PET-CT-scan met 18F-FDG (fluorodesoxyglucose als radioactieve tracer) een belangrijk criterium bij het diagnosticeren van een CDRIE (klasse IIbC).2-9 Dat onderzoek wordt zeer snel positief. Hoe later de diagnose gesteld wordt, des te later zal de behandeling gestart worden, waardoor de morbiditeit en de sterfte ongetwijfeld zullen stijgen als gevolg van complicaties. Als de test positief is met een intense traceropname, kun je de diagnose stellen en kun je ook de behandeling (met antibiotica) volgen als het onderzoek septische embolieën toont. De groep van Juneau D. heeft al in 2017 een algoritme gepresenteerd voor het gebruik van een PET-CT-scan bij vermoeden van een infectie van een CIED (figuur 3).4
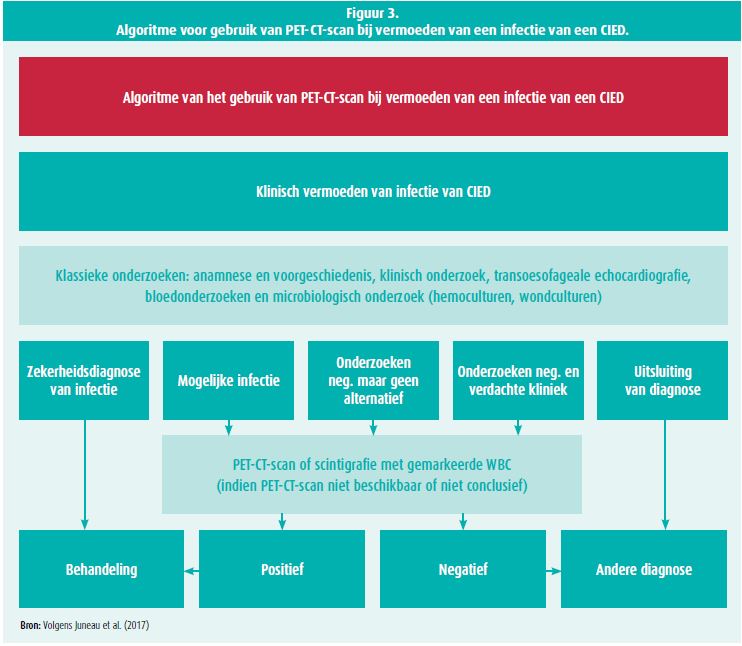
Volgens tal van prospectieve studies zijn de sensitiviteit, de specificiteit, de positieve en de negatieve voorspellende waarde van een PET-scan bij het diagnosticeren van een CDRIE hoger dan 90 %. De gevoeligheid kan echter lager zijn bij herhaalde inname van antibiotica tijdens de laatste dagen voor het onderzoek. En aangezien de ruimtelijke resolutie niet perfect is, kan een vegetatie kleiner dan 1 cm onopgemerkt blijven. Omgekeerd geeft een kunstklep vaak fout-positieve uitkomsten. Jaren na de operatie wordt immers nog glucose opgenomen, wat de waarde van het onderzoek in die gevallen vermindert. Er zijn nog andere situaties die fout-positieve uitkomsten kunnen geven: hogere opname van glucose door een kanker, de eerste dagen na de operatie, een infectie of een andere ontstekingsziekte. Een ander belangrijk element waar je rekening mee moet houden, is dat het myocard van nature uit FDG opneemt. Bij een infectie van een elektrode kunnen de sensitiviteit en de specificiteit daardoor minder goed zijn dan bij een infectie van de doos, ook als er geen infectie van het myocard is. Om dat probleem te verhelpen, moet je “het hart van de patiënt voorbereiden”: nuchter blijven, vetrijke en koolhydraatarme voeding en toediening van niet-gefractioneerde heparine verminderen de opname van de tracer door het myocard.
Na de PET-CT-scan werd een radicale behandeling uitgevoerd met verwijdering van de ICD en de elektroden, en antibiotica. Zes weken later was de patiënt volledig genezen. De literatuur leert dat de sterfte hoog is en dat er snel een recidief optreedt als enkel een medische behandeling gegeven wordt (zelfs bij vermoeden in geval van een occulte infectie zonder duidelijke andere bron dan de PM/ICD). De extractie zelf is niet ongevaarlijk (sterfte van 0,1-0,6 %) en een transveneuze procedure zou enkel uitgevoerd mogen worden in ervaren centra (met een hoog volume). Een chirurgische behandeling is mogelijk als de vegetaties groter zijn dan 2 cm. In 3-15 % van de gevallen weigert de patiënt de extractie of vindt het medisch team een extractie niet wenselijk als die niet zonder risico uitgevoerd kan worden.
Besluit
Een PET-CT-scan is bijzonder gevoelig bij patiënten met een geringe of intermediaire pretestwaarschijnlijkheid van CDRIE, bijvoorbeeld patiënten met een CIED en koorts van onbekende oorsprong en bij wie de hemoculturen en de transoesofageale echocardiografie negatieve uitkomsten geven. Dat is momenteel de belangrijkste indicatie voor een PET-CTscan. Het onderzoek wordt steeds vaker aangevraagd in de klinische praktijk. Daarom betreuren we dat de laatste richtlijnen (ESC 2015) geen belangrijker plaats toekennen aan het onderzoek. Grotere, prospectieve, multicentrische studies zijn wenselijk om de waarde van dat onderzoek definitief te bevestigen.
Referenties
- Habib, G., Lancellotti, P., Antunes, M.J. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio- Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J, 2015, 36, 3075-3128.
- Gomes, A., Slart, R.H., Sinha, B., Glaudemans, A.W. F-FDG-PET/CT in the diagnostic workup of infective endocarditis and related intracardiac prosthetic material: a clear message. J Nucl Med, 2016, 57, 1669-1671.
- Rouzet, F., Le Guludec, D. F-Fluorodeoxyglucose Positron Emission Tomography- Computed Tomography in Cardiac Implantable Electronic Devices Infection. Circ Cardiovasc Imaging, 2017, 10. pii: e006321.
- Juneau, D., Golfam, M., Hazra, S. et al. Positron Emission Tomography and Single-Photon Emission Computed Tomography Imaging in the Diagnosis of Cardiac Implantable Electronic Device Infection. Circ Cardiovasc Imaging, 2017, 10. pii: e005772.
- Sohail, M.R., Baddour, L.M. Role of PET Imaging in Management of Implantable Electronic Device Infection. JACC Cardiovasc Imaging, 2016, 9, 291-293.
- Camus, C. Infections graves liées aux stimulateurs cardiaques et défibrillateurs implantables. Réanimation, 2008, 17, 225-232.
- Ahmed, F.Z., James, J., Cunnington, C. et al. Early diagnosis of cardiac implantable electronic device generator pocket infection using 18F-FDG-PET/CT. Eur Heart J Cardiovasc Imaging, 2015, 16, 521-530.
- Graziosi, M., Nanni, C., Lorenzini, M. et al. Role of 18F-FDG PET/CT in the diagnosis of infective endocarditis in patients with an implanted cardiac device: a prospective study. Eur J Nucl Med Mol Imaging, 2014, 41, 1617-1623.
- Erba, P.A., Lancellotti, P., Vilacosta, I. et al. Recommendations on nuclear and multimodality imaging in IE and CIED infections. Eur J Nucl Med Mol Imaging, 2018, 45, 1795-1815.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.