
Introduction
L'endocardite infectieuse due à l'implant cardiaque (CDRIE: Cardiac Device-Related Infective Endocarditis) est une pathologie rare, mais dont l'incidence est en constante augmentation, parallèlement au nombre d'implantation de pacemakers (PM) et de défibrillateurs implantables (ICD: Implantable Cardioverter Defibrillator) ces dernières années.1 Son taux de mortalité est majeur en cas d'abstention thérapeutique (antibiothérapie et extraction de l'implant et des sondes): il peut avoisiner les 40 % à 1 an. Un diagnostic précoce, avec les critères majeurs et mineurs de Duke, est donc requis; celui-ci est parfois rendu difficile vu la grande variabilité de la présentation clinique et de la faiblesse de certains critères. En effet, l'échographie cardiaque par voie transoesophagienne (ETO) est peu concluante dans plus de 30 % des cas et les hémocultures négatives dans 30 % des cas. Dans la dernière version des guidelines sur les endocardites infectieuses, la Société Européenne de Cardiologie (ESC 2015) met en avant l'intérêt de la Tomographie par émission de Positrons (PET-scanner ou PET-CT) et son utilisation comme critère majeur en cas de positivité du test.1 Sa rentabilité semble excellente en cas de doute diagnostic de l'imagerie cardiaque classique, telle que l'ETO ou le scanner.
Nous présentons un cas clinique récent où un diagnostic certain d'endocardite d'un ICD a pu se faire uniquement grâce au PET-CT. Nous rappelons son intérêt dans le diagnostic de CDRIE, mais aussi les risques de faux-positifs ou faux-négatifs liés à la technique.2-9 Les implications thérapeutiques sont aussi majeures pour le patient (retrait du matériel, antibiothérapie prolongée, hospitalisation longue, replacement de l'implant …).
Observation clinique
Un homme de 55 ans, porteur d'un ICD depuis un mois pour bloc suprahissien et syncope sur TV, est admis dans le Service de cardiologie après un séjour aux Soins intensifs pour sepsis à MSSA (methicillin- sensitive Staphylococcus aureus - Staphylococcus aureus sensible à la méthicilline) d'origine indéterminée. Le patient a des antécédents de cardiopathie ischémique séquellaire (infarctus ancien), des épisodes de FA paroxystique sous rivaroxaban (Xarelto®), et des facteurs de risque (tabac et diabète de type II non insulino-requérant).
à l'admission, le patient se plaint d'une faiblesse généralisée avec grosse impotence fonctionnelle résultante. Il a des douleurs thoraciques pariétales gauches, non liées à l'effort, sans irradiation. Il mentionne également des dorsalgies hautes depuis son admission aux soins intensifs, d'allure plutôt mécanique.
Cliniquement, nous observons un patient pâle et transpirant, légèrement polypnéique. Il est apyrétique, avec un pouls régulier à 120 battements par minute. L'auscultation cardiaque est sans particularité, l'auscultation pulmonaire révèle des crépitants basaux bilatéraux. La percussion du rachis n'est pas douloureuse. La région d'implantation du défibrillateur n'est pas sensible à la palpation et ne montre pas d'érythème ou de signe d'infection. L'examen cutané des extrémités est sans particularité.
Les examens complémentaires réalisés sont les suivants:
- Hémocultures: positives pour un MSSA à l'admission aux Soins intensifs et négatives à 3 jours après administration d'antibiotiques. Dans les infections précoces de CIED (Cardiac Implantable Electronic Device), le staphylocoque doré est en effet le germe le plus fréquemment mis en cause.
- ETO: mise en évidence d'un épaississement focal de 5x5 mm de la sonde de pacemaker au niveau de l'oreillette droite.
- Scanner thoraco-abdominal: pas de collection à hauteur du boîtier de pacemaker, sous réserve d'importants artéfacts métalliques. Visualisation d'une quinzaine de foyers de condensation pulmonaire, distribués de façon aléatoire dans les deux poumons. Pas d'argument pour une spondylodiscite.
- PET-CT montrant de multiples foyers compatibles avec autant de lésions infectieuses:
- Autour du boîtier de défibrillateur et de la sonde ventriculaire le long de son trajet sous-clavier uniquement (figures 1-2);
- Suspicion de spondylodiscite C5-C6 et C6-C7;
- Multiples foyers dans les deux champs pulmonaires.
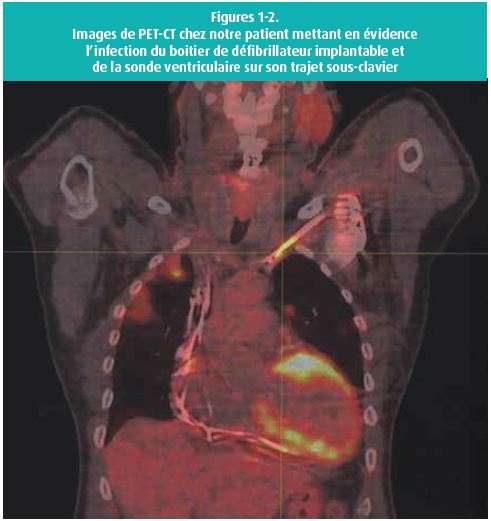
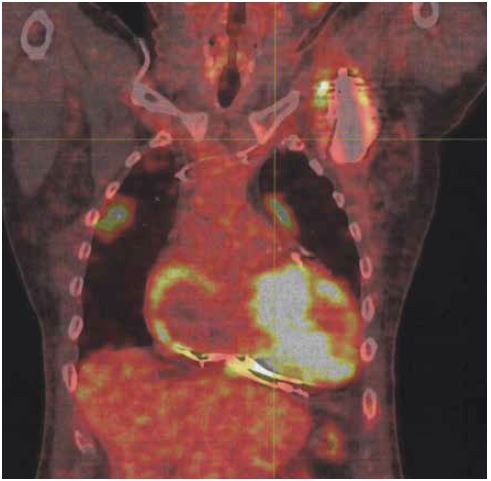
Notons que les lésions pulmonaires comme observées chez notre patient sont une des complications fréquentes des infections sur CIED. En intégrant la présence de telles lésions au PET-CT comme critère majeur de suspicion d'infection, on augmente encore la sensibilité du test!
Nous avons donc confirmé sur base de cet examen le diagnostic de CDRIE et proposé un traitement curatif total. Suite au retrait du défibrillateur et mise en place d'un traitement antibiotique au long cours par flucloxacilline (Floxapen®) et rifampicine (Rifadine®), nous allons observer une bonne évolution tant clinique que biologique pour notre patient. Un défibrillateur sous-cutané (S-ICD) est placé par la suite. Le suivi à 5 mois est satisfaisant … et le patient a même recommencé à fumer!
Discussion
L'endocardite infectieuse due à un CIED est une pathologie rare, mais dont l'incidence est en constante augmentation, estimée de 0,5 et 5 % des cas, parallèlement au nombre d'implantation PM et de ICD. Notons toutefois que l'infection de l'implant n'implique pas systématiquement une endocardite (CDRIE), mais qu'il s'agit là de sa complication la plus grave! Lorsque l'infection est localisée à la poche de l'implant, on parle de LDI (Local Device Infection). Dans plus de 70 % des cas, le pathogène responsable est un staphylocoque épidermidis dans les formes tardives et un staphylocoque doré dans les formes précoces.
Le diagnostic est souvent évident avec les critères majeurs et mineurs de Duke: hémocultures positives pour un staphylocoque, abcès sous-cutané visible au niveau du site d'implantation, ETO montrant des végétations au niveau des sondes. Parfois cependant, il est nettement plus complexe, notamment dans les cas de bilan de fièvre d'origine indéterminée chez un patient porteur de PM ou d'ICD, d'ETO peu contributive, d'hémocultures négatives suite à la prise d'antibiotiques … ou simplement de présentation atypique.
Il existe aussi des facteurs de risque de CDRIE à prendre en considération, soit liés au patient (insuffisance rénale chronique, usage de corticoïdes, cancer, insuffisance cardiaque, diabète, prise d'anticoagulants) ou selon le type de procédure (révision ou remplacement, expérience de l'opérateur, durée de procédure, absence de prophylaxie antimicrobienne, sonde de pacing temporaire per-procédure).
Pour le diagnostic, les deux examens classiquement recommandés en classe IC (ESC 2015) sont les hémocultures et l'ETO, peu contributives dans 30 % des cas. L'ETO ne permet pas la visualisation de la portion extracardiaque des sondes et le risque unique de LDI; cette atteinte extracardiaque modifie considérablement la prise en charge avec absence de retrait des sondes.1 L'ETO peut ne pas toujours distinguer une vraie végétation d'un thrombus ou d'un filament mobile sur une sonde; l'incidence des filaments est estimée à 10-15 % lors d'échographie transthoracique et de 30 % lorsque l'examen est une échographie intracardiaque (ICE) réalisée lors de procédure d'ablation. Ceci peut mener à une mauvaise prise en charge. Notons également qu'en cas d'infection localisée au générateur, les hémocultures reviendront négatives.
Dans ce cadre, le PET-CT avec comme traceur radioactif le fluorodésoxyglucose, abrégé en 18F-FDG, est reconnu comme un élément de critère majeur pour le diagnostic de CDRIE, mais recommandé en classe IIbC.2-9 Son atout est qu'il se révèle positif très précocement. Or, au plus le diagnostic est posé tardivement, au plus on retarde la prise en charge thérapeutique, ce qui conduit inéluctablement à une augmentation des complications de type morbi-mortalité. Un test positif, avec captation intense du traceur, permet le diagnostic, mais aussi un suivi thérapeutique (ou antibiotique) en cas de mise en évidence d'emboles septiques. Juneau D. et son équipe ont d'ailleurs déjà proposé, en 2017, un algorithme incluant l'utilisation du PET-CT dans l'investigation des suspicions d'infection de CIED (figure 3).4
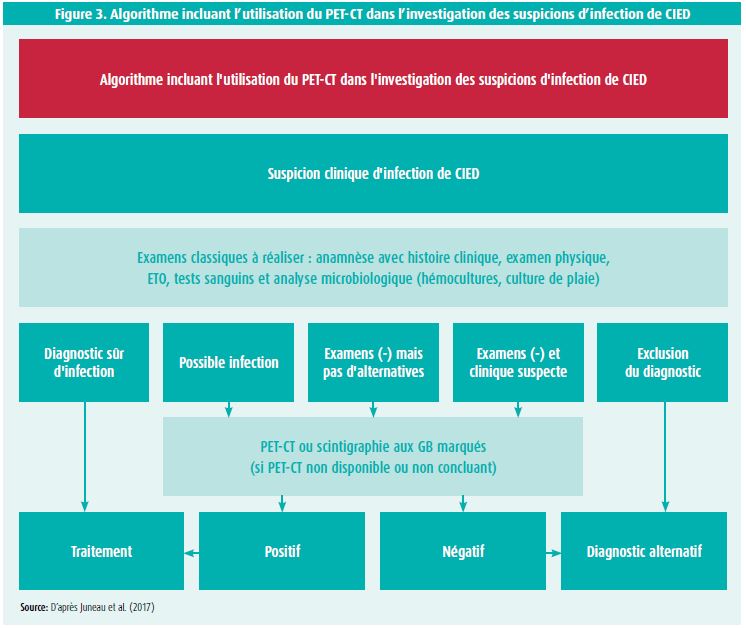
Après analyse de nombreuses études prospectives, il apparaît que l'utilisation du PET-CT offre une sensibilité, une spécificité, une VPP et une VPN supérieures à 90 % pour le diagnostic de CDRIE. Toutefois, la sensibilité du PET-CT peut être diminuée en cas de prise récurrente d'antibiotiques dans les jours qui précèdent l'examen, et la résolution spatiale n'étant pas parfaite, une végétation infra-centimétrique pourrait passer inaperçue. à l'inverse, il apparaît que la présence d'une valve prothétique donne beaucoup de faux-positifs: il persiste en effet une prise du glucose des années après chirurgie, ce qui remet en cause l'utilisation de cette technique dans ces cas. D'autres situations associent des faux-positifs: la captation du glucose augmentée dans les néoplasies, le statut post-opératoire précoce, en cas de processus infectieux ou toute autre pathologie inflammatoire. Un autre élément important à prendre en considération est la captation myocardique naturelle du FDG. En effet, pour les infections de sondes, la sensibilité et la spécificité peuvent être moins bonnes que pour les infections de générateur, notamment du fait qu'il existe un captage myocardique naturel (sans infection nécessaire). Pour pallier en partie à ce problème, la 'préparation cardiaque' du patient apparaît essentielle; jeûne, régime riche en graisses et pauvre en hydrates de carbones, administration d'héparine non-fractionnée sont des moyens qui permettent de diminuer cette captation myocardique.
Grâce au PET-CT, un traitement radical associant le retrait de l'ICD et des sondes, associé à une antibiothérapie a permis une guérison complète du patient à 6 semaines du suivi. Les données de la littérature montrent qu'un traitement médical seul entraine une mortalité élevée et des récidives précoces (même si suspicion dans le cas d'infection occulte sans autre source apparente que la présence d'un PM/ICD). Notons que la procédure d'extraction est à risque avec un taux de décès de 0,1-0,6 %; une procédure transveineuse est souhaitée uniquement dans des centres expérimentés (haut volume).
Une cure chirurgicale est possible si les végétations sont d'une taille de plus de 2 cm. Dans 3-15 % des cas, il existe un refus d'extraction par le patient ou des cas non souhaitables (par l'équipe médicale) pour une extraction pas sans risque.
Conclusion
Le PET-CT est particulièrement sensible chez des patients avec suspicion clinique pré-test faible ou intermédiaire de CDRIE, par exemple chez les patients porteurs d'un device avec une fièvre d'origine indéterminée et chez qui les hémocultures et/ou l'ETO reviennent négatives. Il s'agit à l'heure actuelle de son indication principale. Malgré son utilisation de plus en plus fréquente en pratique clinique, nous déplorons le fait qu'à ce jour, les dernières guidelines (ESC 2015) ne lui attribuent toujours pas une place plus importante. La réalisation de plus larges études prospectives multicentriques constituerait un moyen pour conforter définitivement cet examen dans les futurs guidelines.
Références
- Habib, G., Lancellotti, P., Antunes, M.J. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio- Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J, 2015, 36, 3075-3128.
- Gomes, A., Slart, R.H., Sinha, B., Glaudemans, A.W. F-FDG-PET/CT in the diagnostic workup of infective endocarditis and related intracardiac prosthetic material: a clear message. J Nucl Med, 2016, 57, 1669-1671.
- Rouzet, F., Le Guludec, D. F-Fluorodeoxyglucose Positron Emission Tomography- Computed Tomography in Cardiac Implantable Electronic Devices Infection. Circ Cardiovasc Imaging, 2017, 10. pii: e006321.
- Juneau, D., Golfam, M., Hazra, S. et al. Positron Emission Tomography and Single-Photon Emission Computed Tomography Imaging in the Diagnosis of Cardiac Implantable Electronic Device Infection. Circ Cardiovasc Imaging, 2017, 10. pii: e005772.
- Sohail, M.R., Baddour, L.M. Role of PET Imaging in Management of Implantable Electronic Device Infection. JACC Cardiovasc Imaging, 2016, 9, 291-293.
- Camus, C. Infections graves liées aux stimulateurs cardiaques et défibrillateurs implantables. Réanimation, 2008, 17, 225-232.
- Ahmed, F.Z., James, J., Cunnington, C. et al. Early diagnosis of cardiac implantable electronic device generator pocket infection using 18F-FDG-PET/CT. Eur Heart J Cardiovasc Imaging, 2015, 16, 521-530.
- Graziosi, M., Nanni, C., Lorenzini, M. et al. Role of 18F-FDG PET/CT in the diagnosis of infective endocarditis in patients with an implanted cardiac device: a prospective study. Eur J Nucl Med Mol Imaging, 2014, 41, 1617-1623.
- Erba, P.A., Lancellotti, P., Vilacosta, I. et al. Recommendations on nuclear and multimodality imaging in IE and CIED infections. Eur J Nucl Med Mol Imaging, 2018, 45, 1795-1815.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.