BSC-sessieverslag - sessie 4 - BWGBRC
Sandrine Horman en Michel De Pauw modereerden de sessie van de BWGBRC (Belgian Working Group of Basic Research in Cardiology) tijdens het congres 2021 van de Belgische Vereniging voor Cardiologie. E. Dale Abel (University of Iowa City, VS) opende de sessie met een presentatie die focuste op de metabole wijzigingen die kenmerkend zijn voor het diabetische hart. Daarna besprak Christian Schulze (University Hospital of Jena, Duitsland) de lipotoxiciteit die geassocieerd is met hartfalen. Tot slot presenteerde Walter Paulus (University Medical Center, Amsterdam, Nederland) experimentele bewijzen die staven dat er een verband bestaat tussen de ontsteking, de microvasculaire wijzigingen en de diastolische disfunctie bij patiënten met hartfalen met gepreserveerde ejectiefractie.
Diabetisch hart
Een van de belangrijkste kenmerken van het hartmetabolisme is zijn flexibiliteit. Het hart is immers in staat om tal van energiebronnen te gebruiken, vooral vetzuren, glucose, lactaat, ketonlichamen en bepaalde aminozuren. De keuze van de energiebron hangt af van de beschikbaarheid van de substraten, van de energiebehoeften en van de hormonale toestand. In nuchtere toestand produceert het hart zijn energie via oxidatie van vetzuren, terwijl postprandiaal de oxidatie van glucose de energie levert. Deze metabole flexibiliteit is essentieel om de hartcel en het contractiele apparaat intact te houden. Ze komt echter in het gedrang bij een diabetisch hart, wat leidt tot een aandoening genaamd diabetische cardiomyopathie, die losstaat van coronaire aandoeningen en arteriële hypertensie.
Al jaren geleden heeft het onderzoek van E. Dale Abel aangetoond dat er uiteenlopende pathofysiologische factoren zijn die een verband creëren tussen door diabetes geïnduceerde wijzigingen in de myocardiale omgeving en cardiale disfunctie1. Van die factoren dragen dyslipidemie, hyperglykemie en insulineresistentie bij tot het ontstaan van metabole inflexibiliteit. Ook als er hyperglykemie optreedt, gebruikt het diabetische hart immers voornamelijk de circulerende vetzuren om de totaliteit van zijn energie te produceren, en dit ongeacht de hormonale of nutritionele omstandigheden. De ongecontroleerde toename van de oxidatie van de vetzuren veroorzaakt vervolgens een massieve aanmaak van reducerende equivalenten (NADH en FADH2) die het oxidatievermogen van de ademhalingsketen te boven gaan en tot een overproductie van reactieve zuurstofsoorten leiden. Deze oxidatieve stress verergert de mitochondriale disfunctie, waardoor de toevoer van energie die nodig is om het contractiele apparaat naar behoren te laten werken, nog afneemt. Verschillende mechanismes spelen een rol bij het ontstaan van deze metabole inflexibiliteit, onder ander insulineresistentie en de activatie door de lipiden van de signalisatieroute van de peroxisome proliferator-activated receptor α (PPAR α) (figuur 1). Kenmerkend voor diabetische cardiomyopathie is ook de accumulatie van vetzuren in de hartspiercel. Die komen voor in de vorm van triglyceriden, maar ook van toxische lipidenderivaten zoals ceramiden die zich op het mitochondrium richten, meer oxidatieve stress creëren en de hartspiercellen vernietigen door apoptose (figuur 1).
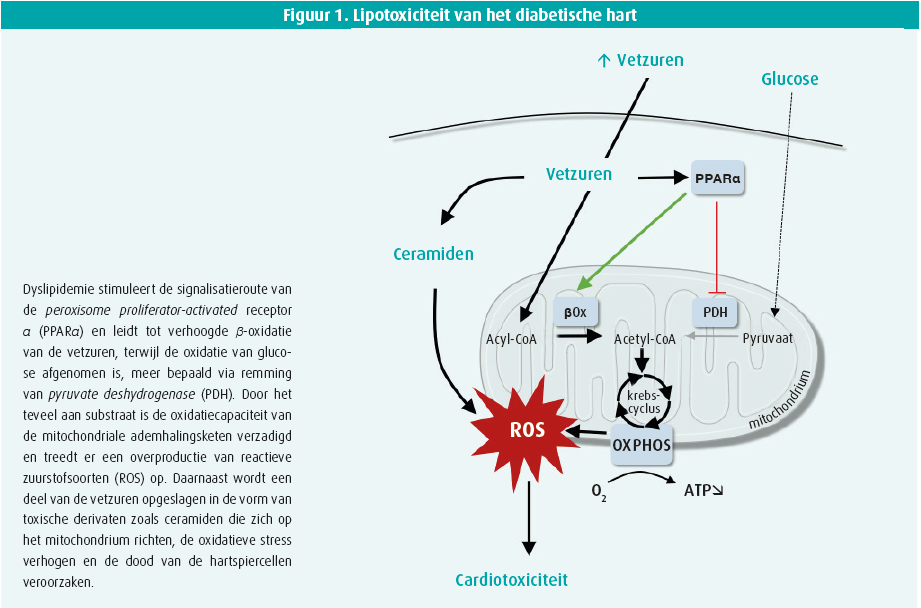
E. Dale Abel belichtte ook de schadelijke effecten van hyperglykemie, en meer bepaald de toename van O-GlcNacylatie van de eiwitten. Die posttranslationele modificatie tast onder andere de reabsorptie van calcium in het sarcoplasmatisch reticulum aan en kan leiden tot een verminderde contractiliteit via de wijziging van de activatie van het IIδ-kinase-eiwit dat afhankelijk is van calcium en van calmoduline (CaMKIIδ), een belangrijke regulator van de hartspiercelfunctie. Daarnaast veroorzaakt het teveel aan glucose een verandering in de genexpressie, wat ook leidt tot een ingrijpende hermodellering van het mitochondriale hartmetabolisme ten voordele van de oxidatie van de vetzuren2.
Al deze wijzigingen monden uiteindelijk uit in een voornamelijk diastolische disfunctie, en zo in een verhoogd risico op hartfalen.
Lipotoxiciteit en hartfalen
Ook een afgenomen metabole flexibiliteit van het hart is een van de kenmerken van hartfalen. In die omstandigheden stellen we een daling van de oxidatie van de vetzuren vast, wat de accumulatie van toxische lipidenbemiddelaars in de hartspiercel bevordert. In zijn presentatie besprak Christian Schulze verschillende essentiële resultaten die verkregen zijn in studies van zijn onderzoeksteam naar de lipotoxiciteit die gepaard gaat met hartfalen3. Hij toonde onder andere aan dat deze pathologie samengaat met een stijging van de circulerende en cardiale niveaus van acylcarnitine met zeer lange ketens, wat overigens correleert met de ernst van de ziekte4. Ceramiden met zeer lange ketens zijn een ander voorbeeld van lipidenbemiddelaars die verhoogd zijn in het plasma en het hart van de patiënten. Ze bestaan uit een sfingosinemolecule gekoppeld aan een vetzuur en worden gesynthetiseerd via drie belangrijke routes. Bij één daarvan (de-novosynthese) treedt condensatie van palmitoyl-CoA en van een serine op door serinepalmitoyltransferase (SPTLC2), een restrictie-enzym van de route waarvan de expressie verhoogd is bij hartfalen. Net als deletie van het SPTLC2-gen in een muizenmodel leverde de farmacologische remming van dit enzym met myriocine een daling van de ceramidenconcentratie op en kon het hartfalen na een infarct voorkomen5. Overexpressie van ceramidesynthase (CerS2) die de vorming van ceramiden op basis van sfingosine catalyseert (reddingsroute), gaat daarentegen gepaard met een accumulatie van ceramiden, met activatie van proapoptotische routes, stoornissen van het oxidatieve metabolisme of ook nog mitofagie als gevolg6. Deze studies hebben het mogelijk gemaakt om moleculaire mechanismes aan te tonen die eventueel het doel kunnen vormen van nieuwe behandelingsstrategieën om het metabolisme te manipuleren en zo de progressie van hartfalen af te remmen.
Centrale rol van het microvasculaire endothelium in de pathofysiologie van HFpEF
Er zijn hoofdzakelijk twee vormen van hartfalen beschreven: (1) systolische disfunctie in combinatie met dilatatie van het myocard, wat leidt tot een daling van de ejectiefractie (HFrEF); (2) diastolische disfunctie, na concentrische hypertrofie van de hartspier en verhoogde vuldruk, zonder verstoorde ejectiefractie (HFpEF)7. HFrEF ontstaat voornamelijk in pathologische omstandigheden die de integriteit van de hartspiercel aantasten (bijvoorbeeld een myocardinfarct), maar voor HFpEF is het nog altijd moeilijk om een duidelijke oorzaak aan te wijzen. Het staat vast dat de prevalentie van metabole comorbiditeit zoals diabetes zeer hoog is bij HFpEF-patiënten. Deze waarneming leidde tot het paradigma dat stelt dat die metabole comorbiditeit een laaggradige chronische ontsteking kan uitlokken die aan de basis ligt van activatie van het endothelium van de coronaire microarteriën en oxidatieve stress die via de ontkoppeling van stikstofnoxidesynthase (NOS) bijdragen tot een toegenomen omvang en passieve rigiditeit van de hartspiercellen8,9. De centrale bijdrage van het endothelium tot de typische rigiditeit van het myocard bij HFpEF wordt onder andere gestaafd door recente gegevens uit de studie MESA, die de diastolische disfunctie sterk correleren met het metabole syndroom van diabetische HFpEF-patiënten, en dit onafhankelijk van hartfibrose. Dit komt overeen met de gegevens van de groep van Walter Paulus uit 200810. Meer recent, en in lijn met dit paradigma, hebben Frisk et al. de kenmerken van de T-tubuli bestudeerd bij diabetische HFpEF-patiënten en vastgesteld dat de tijd van de Ca2+-reabsorptie door de T-tubuli langer was dan bij patiënten zonder diabetes11. Tot slot blijkt uit een recente studie dat HFpEF-patiënten niet of weinig (< 2 % in een periode van 11 jaar) evolueren naar een HFrEF-fenotype, wat er duidelijk op wijst dat diastolische disfunctie niet de voorloper is van ventriculaire dilatatie en van een verminderde systolische functie12.
Referenties
- Ritchie, R.H., Abel, E.D. Basic Mechanisms of Diabetic Heart Disease. Circ Res, 2020, 126 (11), 1501-1525.
- Wende, A.R., Schell, J.C., Ha, C.M., Pepin, M.E., Khalimonchuk, O., Schwertz, H. et al. Maintaining Myocardial Glucose Utilization in Diabetic Cardiomyopathy Accelerates Mitochondrial Dysfunction. Diabetes, 2020, 69 (10), 2094-2111.
- Kretzschmar, T., Wu, J.M.F., Schulze, P.C. Mitochondrial Homeostasis Mediates Lipotoxicity in the Failing Myocardium. Int J Mol Sci, 2021, 22 (3), 1498.
- Goldenberg, J.R., Carley, A.N., Ji, R., Zhang, X., Fasano, M., Schulze, P.C. et al. Preservation of Acyl Coenzyme A Attenuates Pathological and Metabolic Cardiac Remodeling Through Selective Lipid Trafficking. Circulation, 2019, 139 (24), 2765-2777.
- Ji, R., Akashi, H., Drosatos, K., Liao, X., Jiang, H., Kennel, P.J. et al. Increased de novo ceramide synthesis and accumulation in failing myocardium. JCI Insight, 2017, 2 (14).
- Law, B.A., Liao, X., Moore, K.S., Southard, A., Roddy, P., Ji, R. et al. Lipotoxic verylong- chain ceramides cause mitochondrial dysfunction, oxidative stress, and cell death in cardiomyocytes. FASEB J, 2018, 32 (3), 1403- 1416.
- Pieske, B., Tschope, C., de Boer, R.A., Fraser, A.G., Anker, S.D., Donal, E. et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J, 2019, 40 (40), 3297-3317.
- Paulus, W.J., Tschope, C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol, 2013, 62 (4), 263-271.
- van Heerebeek, L., Hamdani, N., Handoko, M.L., Falcao-Pires, I., Musters, R.J., Kupreishvili, K., et al. Diastolic stiffness of the failing diabetic heart: importance of fibrosis, advanced glycation end products, and myocyte resting tension. Circulation, 2008, 117 (1), 43-51.
- Ladeiras-Lopes, R., Moreira, H.T., Bettencourt, N., Fontes-Carvalho, R., Sampaio, F., Ambale- Venkatesh, B. et al. Metabolic Syndrome Is Associated With Impaired Diastolic Function Independently of MRI-Derived Myocardial Extracellular Volume: The MESA Study. Diabetes, 2018, 67 (5), 1007-1012.
- Frisk, M. Le, C., Shen, X., Roe, A.T., Hou, Y., Manfra, O. et al. Etiology-Dependent Impairment of Diastolic Cardiomyocyte Calcium Homeostasis in Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol, 2021, 77 (4), 405-419.
- Lupon, J., Gavidia-Bovadilla, G., Ferrer, E., de Antonio, M., Perera-Lluna, A., Lopez-Ayerbe, J. et al. Heart Failure With Preserved Ejection Fraction Infrequently Evolves Toward a Reduced Phenotype in Long-Term Survivors. , 2019, 12 (3), e005652.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.