BSC-congresverslag - S2
Op donderdagochtend vond het door de BWGNICI (Belgian Working Group on Non-Invasive Cardiac Imaging) georganiseerde symposium rond CPET-echo (cardiopulmonary exercise testing of ergospirometrie in combinatie met inspanningsechocardiografie, figuur 1) plaats. Hot topics als het gebruik van CPET-echo bij atleten, patiënten met kleplijden en patiënten met onverklaarde dyspneu kwamen hierbij aan bod. De sessie werd afgesloten met de presentatie van het beste abstract van 2022 binnen het domein van cardiale beeldvorming.
CPET-echo bij kleplijden met discordante symptomen
Jan Verwerft - Jessa Ziekenhuis
Jan Verwerft lichtte de rol van CPET-echo bij patiënten met een discordantie tussen hun symptomen en de ernst van hun hartkleplijden toe. Een inspanningsecho is nuttig om zowel de ernst van het kleplijden (hartdebiet, gradiënten en kleurendoppler), de functionele reserve van het hart en de hemodynamische belasting of pulmonalisdrukken (PAP) te beoordelen.1, 2
De kleprichtlijnen van 2021 bevelen nog altijd een aortaklepvervanging aan wanneer patiënten die zichzelf als asymptomatisch beschouwen, toch klachten ontwikkelen tijdens een inspanningstest als het duidelijk is dat de klachten worden veroorzaakt door de aortaklepstenose.3 Dit laatste is dan ook de toegevoegde waarde van een gelijktijdige ergo- spirometrie: naast enkel klachten kan ook een verminderde inspanningscapaciteit (zuurstofopname of piek VO2) worden geobjectiveerd en kan een niet-cardiale oorzaak zoals pulmonale limitatie, deconditionering (verminderde zuurstofextractie) of een submaximale test worden uitgesloten.4
Met een gevalsbespreking illustreerde Jan Verwerft hoe een CPET-echo bij een patiënt met een matige aortaklepstenose en symptomen een verminderde inspanningscapaciteit en pulmonale hypertensie bij inspanning aantoonde zonder toename van de aortaklepgradiënt.5 De ergospirometrie suggereerde een belangrijke precapillaire factor (desaturatie tijdens inspanning en een erg inefficiënte ventilatie [VE/VCO2 slope > 36 of een abnormale toename van de ventilatie per L CO2-productie]. De symptomen werden dus niet door de aortaklepstenose veroorzaakt, waardoor er dus geen indicatie tot klepinterventie was. Een tweede casus betrof een asymptomatische patiënt met ernstige mitraliskleplekkage (prolaps) en een licht gedilateerd linkerventrikel (LV). De CPET-echo toonde een normale hartreserve, met een pulmonaal arteriële druk proportioneel tot het hoognormale maximale hartdebiet en zuurstofopname. De ernst van de kleplekkage nam niet toe bij inspanning. Een normale maximale VO2 in combinatie met een hoge systolische LV-deformatie (strain) in rust is geassocieerd met een uitstekende prognose indien deze patiënten waakzaam worden opgevolgd6. Desalniettemin blijft er in dit boeiende domein een belangrijke nood aan prospectieve data bestaan.
CPET-echo in de work-up bij atleten
Guido Claessen - UZ Leuven
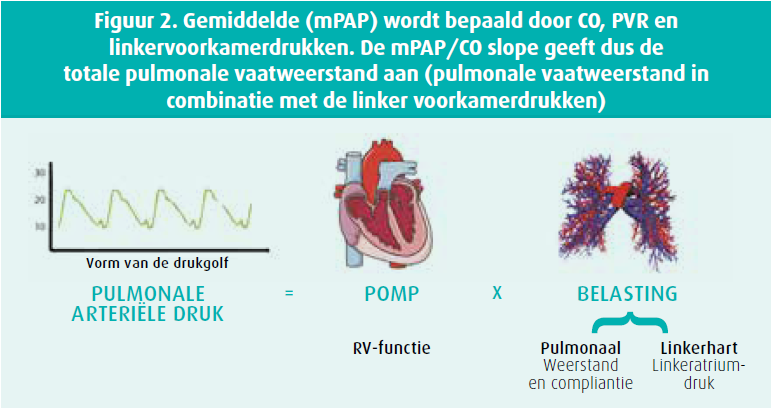
Guido Claessen maakte duidelijk dat het hart van de atleet bij uitstek een machine is die getest moet worden wanneer het doet waarvoor het gemaakt en getraind is: inspanning leveren. Hij illustreerde dit door een wielrenner van hoog niveau te bespreken, met atypische thoracale pijn, die een ejectiefractie (LVEF) van 46 % bleek te hebben, wat in de Pro@ Heart-cohorte niet zeldzaam is (6 % van de topwielrenners). Aangezien de vader van de atleet een cardiomyopathie had, werd toch verder onderzoek gedaan. Het holter-ecg was normaal en genetisch onderzoek is lopende. In deze setting is een CPET-echo bijzonder nuttig. De atleet had namelijk, zoals men verwacht bij gezonde atleten, bij inspanning een LVEF van > 63 % en een absolute toename in LVEF van > 11 %7. Guido Claessen legde vervolgens uit dat de pulmonale vasculaire weerstand, de linkervoorkamerdrukken en het hartdebiet de PAP bepalen tijdens inspanning (figuur 2)8. Hij besprak een patiënt met inspanningsdyspneu die symptomatisch bleef na een longembolie hoewel er geen pulmonale hypertensie was in rust. CPET-echo toonde aan dat de klachten werden veroorzaakt door restletsels van de longembolie doordat de PAP disproportioneel steeg ten opzichte van het hartdebiet (gemiddelde PAP/CO slope 2,3 mmHg/l/min, normaal < 2 mmHg/l/min in jonge populatie), met een belangrijke desaturatie en een opvallend hoge VE/VCO2 slope, wijzend op ventilatieperfusiemismatch.9 Na pulmonale endarterectomie normaliseerden deze afwijkingen. Ook in dit geval was er een belangrijke meerwaarde van de echocardiografische evaluatie tijdens inspanning.
Onverklaarde dyspneu: CPET-echo versus katheterisatie?
Frederik Verbrugge - UZ Brussel
Frederik Verbrugge kreeg daarna het woord en besprak hoe CPET-echo en ergospirometrie met invasieve drukmeting (iCPET) complementair zijn in de evaluatie van onverklaarde dyspneu en de diagnose van hartfalen met EF > 50 % (HFpEF). Frederik Verbrugge stelde een stapsgewijze aanpak voor: met eerst een gedetailleerde echocardiografie en longfunctietest, dan CPET-echo en iCPET als laatste stap. Waar lage natriuretische peptiden (NT-proBNP) klinisch relevant HFpEF niet uitsluiten, doet een normale wiggedruk tijdens inspanning dat wel.10 Een wiggedruk > 25 mmHg is dé gouden standaard voor de diagnose van HFpEF. CPET-echo is vaak voldoende bij een intermediaire kans op HFpEF volgens de H2FPEF-score (1-5 punten op basis van eenvoudige klinische en echocardiografische criteria) in combinatie met een hoge E/e' (verhouding tussen bloedstroomsnelheid over de mitralisklep en vroeg-diastolische snelheid van de mitralisklepannulus) en pulmonale hypertensie bij inspanning (figuur 3).11, 12 Frederik Verbrugge lichtte toe dat er beperkingen zijn aan CPET-echo: het hartdebiet bij inspanning wordt systematisch wat onderschat en, indien de rechteratriumdrukken sterk oplopen, worden ook de pulmonalisdrukken eerder onderschat zodat de verhouding van beide - de mPAP/CO slope - wel nauwkeurig blijft.13 Dus, wanneer gedetailleerde fenotypering nodig is om therapeutische beslissingen te nemen, heeft iCPET een meerwaarde bovenop CPET-echo. Er verschijnen namelijk interventies voor HFpEF aan de horizon: zoals shunt devices voor HFpEF met een lage pulmonale vaatweerstand tijdens inspanning, en percutane pericardiotomie voor HFpEF met drukegalisatie van de rechter en linker vullingsdrukken door verhoogde pericardiale druk bij epicardiale vetstapeling.

Best Abstract: Outcome penalty of guidelines surgical triggers in severe aortic regurgitation
Vincent Hanet - UCLouvain
Vincent Hanet ten slotte, won de prijs voor het beste abstract in cardiale beeldvorming en mocht zijn onderzoek als mondeling abstract voorstellen. Voor ernstige asymptomatische aortaklepinsufficiëntie (AI) zijn er volgens de meest recente internationale kleprichtlijnen strikte (klasse I) indicaties voor aortaklepvervanging (EF ≤ 50 % en LV-diameter > 55 mm of 25 mm/m² en nieuwe, meer laagdrempelige (klasse IIa) indicaties (EF ≤ 55 % en LV-diameter 20 mm/m²). Vincent Hanet presenteerde de 10-jaarsoverleving van een wereldwijde cohorte (AVIATOR) van 1 899 patiënten geopereerd wegens ernstige AI. Eerder onderzoek had al getoond dat aortaklepheelkunde vanaf de conservatieve (klasse I) indicatie een minder goede overleving heeft dan een eerdere interventie.14 De vraag is of patiënten deze prijs niet betalen als de interventie gebeurt op basis van de minder conservatieve (klasse IIa) indicaties. De resultaten van het onderzoek van Vincent Hanet bevestigen dat preoperatieve symptomen, EF < 50 % en diameter > 50 mm en 25 mm/m², een minder goede overleving voorspellen. Patiënten die aortaklepheelkunde ondergingen op basis van een preoperatieve diameter > 20 mm/m² en EF < 55 % hadden geen verminderde postoperatieve overleving. Een gerandomiseerde studie zou hierover uitsluitsel moeten brengen. De moderatoren merkten wel op dat de bestudeerde cohorte een erg geselecteerde populatie betreft in expert-centra, met een zeer hoog percentage van klepherstel in deze cohorte.
Referenties
- Lancellotti, P., Pellikka, P.A., Budts, W., Chaudhry, F.A., Donal, E., Dulgheru, R. et al. The clinical use of stress echocardiography in non-ischaemic heart disease: recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging, 2016, 17 (11), 1191-229.
- Vahanian, A., Beyersdorf, F., Praz, F., Milojevic, M., Baldus, S., Bauersachs, J. et al. 2021 ESC/ EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2021.
- Martens, P., Herbots, L., Timmermans, P., Verbrugge, F.H., Dendale, P., Borlaug, B.A. et al. Cardiopulmonary Exercise Testing with Echocardiography to Identify Mechanisms of Unexplained Dyspnea. J Cardiovasc Transl Res, 2022, 15 (1), 116-130.
- Stassen, J., Ewe, S.H., Butcher, S.C., Amanullah, M.R., Hirasawa, K., Singh, G.K. et al. Moderate aortic stenosis: importance of symptoms and left ventricular ejection fraction. Eur Heart J Cardiovasc Imaging, 2021, 23 (6), 790-799.
- Mentias, A., Naji, P., Gillinov, A.M., Rodriguez, L.L., Reed, G., Mihaljevic, T. et al. Strain Echocardiography and Functional Capacity in Asymptomatic Primary Mitral Regurgitation With Preserved Ejection Fraction. J Am Coll Cardiol, 2016, 68 (18), 1974-1986.
- Claessen, G., Schnell, F., Bogaert, J., Claeys, M., Pattyn, N., De Buck, F. et al. Exercise cardiac magnetic resonance to differentiate athlete's heart from structural heart disease. Eur Heart J Cardiovasc Imaging, 2018, 19 (9), 1062-1070.
- La Gerche, A., MacIsaac, A.I., Burns, A.T., Mooney, D.J., Inder, W.J., Voigt, J.U. et al. Pulmonary transit of agitated contrast is associated with enhanced pulmonary vascular reserve and right ventricular function during exercise. J Appl Physiol, 1985, 2010, 109 (5), 1307-1317.
- Lewis, G.D., Bossone, E., Naeije, R., Grünig, E., Saggar, R., Lancellotti, P. et al. Pulmonary vascular hemodynamic response to exercise in cardiopulmonary diseases. Circulation, 2013, 128 (13), 1470-1479.
- Verbrugge, F.H., Omote, K., Reddy, Y.N.V., Sorimachi, H., Obokata, M., Borlaug, B.A. Heart failure with preserved ejection fraction in patients with normal natriuretic peptide levels is associated with increased morbidity and mortality. Eur Heart J, 2022, 43 (20), 1941-1951.
- Reddy, Y.N.V., Carter, R.E., Obokata, M., Redfield, M.M., Borlaug, B.A. A Simple, Evidence-Based Approach to Help Guide Diagnosis of Heart Failure With Preserved Ejection Fraction. Circulation, 2018, 138 (9), 861-870.
- Pieske, B., Tschope, C., de Boer, R.A., Fraser, A.G., Anker, S.D., Donal, E. et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J, 2019, 40 (40), 3297-3317.
- Claessen, G., La Gerche, A., Voigt, J.U., Dymarkowski, S., Schnell, F., Petit, T. et al. Accuracy of Echocardiography to Evaluate Pulmonary Vascular and RV Function During Exercise. JACC Cardiovasc Imaging, 2016, 9 (5), 532-543.
- de Meester, C., Gerber, B.L., Vancraeynest, D., Pouleur, A-C., Noirhomme, P., Pasquet, A. et al. Do Guideline-Based Indications Result in an Outcome Penalty for Patients With Severe Aortic Regurgitation? JACC Cardiovasc Imaging, 2019, 12 (11), 2126-2138.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.