Hartfalen is frequent en veroorzaakt ondanks de aanwinsten van de laatste decennia nog altijd veel morbiditeit en een hoge sterfte. Sinds geruime tijd maken we onderscheid tussen hartfalen met een gedaalde linkerventrikelejectiefractie en hartfalen met een gevrijwaarde of intermediaire linkerventrikelejectiefractie (LVEF), maar de prognose blijft dezelfde. Al sinds de eerste richtlijnen wordt gediscussieerd over de vraag of de behandeling verschilt naargelang de ejectiefractie. De behandeling van hartfalen als gevolg van een systolische linkerventrikeldisfunctie staat al lang goed op punt (hoewel die toch geleidelijk is aangepast) dankzij overtuigende gerandomiseerde studies, maar over de behandeling van hartfalen met een gevrijwaarde linkerventrikelfunctie wordt nog altijd verwoed gediscussieerd. Ook daar schijnt echter toch langzaamaan verandering in te komen.
De eerste richtlijnen van de Europese Vereniging voor Cardiologie ad hoc dateren van 2001. Toen werd er gesproken over systolische en diastolische disfunctie. Over de behandeling van diastolische disfunctie werd niet veel gediscussieerd: er werden weinig klinische studies of zelfs observatieonderzoeken uitgevoerd over de behandeling ervan en nog minder over de prevalentie. Naar schatting zou ongeveer 40 % van de oudere patiënten die in het ziekenhuis wordt opgenomen, symptomen vertonen van hartfalen met een normale systolische functie. Bij de publicatie van de volgende richtlijnen in 2005 was er weinig veranderd op epidemiologisch vlak. Overwegend diastolisch hartfalen werd als zeldzaam beschouwd bij jongere patiënten en frequenter bij oudere. Vrouwen met systolische hypertensie en linkerventrikelhypertrofie met fibrose waren de doelgroep. Opnieuw niets over de behandeling.
In 2012 is de benaming veranderd naar een 'modernere' versie. Sindsdien onderscheiden we hartfalen met een gedaalde linkerventrikelejectiefractie (HFrEF) en hartfalen met een gevrijwaarde linkerventrikelejectiefractie (HFpEF). De diagnose van beide werd gesteld op grond van typische symptomen en tekenen van hartfalen bij anamnese en klinisch onderzoek. Een diagnose van HFrEF werd gesteld als de LVEF was gedaald (tot minstens ongeveer 35-40 %, zonder verdere precisering). Een diagnose van HFpEF werd gesteld als de LVEF normaal of slechts licht gedaald was en als er een significante afwijking van het hart aangetoond kon worden (linkerventrikelhypertrofie, verwijding van de linkervoorkamer, tekenen van diastolische disfunctie, die hoofdzakelijk geëvalueerd werden met een doppler). De behandeling van HFrEF was goed omschreven en was sterk verbeterd, maar er waren geen aanwijzingen dat een behandeling de morbiditeit en de sterfte bij patiënten met een HFpEF verminderde. Klinische studies hebben niet kunnen aantonen dat bijvoorbeeld angiotensineconverterend- enzymremmers (PEP-CHF met perindopril) of angiotensine II-receptorantagonisten (CHARM-Preserved met candesartan, I-Preserve met irbesartan) doeltreffend zijn. Over de TOPCAT-studie in 2014 met spironolacton is veel te doen geweest, maar die studie heeft niet veel zoden aan de dijk gezet: het aantal ziekenhuisopnames wegens hartfalen daalde wel met 17 %, een verschil dat net statistisch significant was (p = 0,04), maar daar werd een prijs voor betaald: verergering van nierinsufficiëntie en hyperkaliëmie.
De richtlijnen van 2016 hebben alleen maar kunnen vaststellen dat van geen enkele behandeling bewezen was dat ze werkelijk een gunstig effect heeft bij HFpEF. Bij de behandeling van HFrEF bleef het winnende trio (angiotensineconverterend-enzymremmer, bètablokker en aldosteronantagonist) stevig in het zadel. De combinatie valsartan- sacubitril was de enige nieuwigheid (dankzij de PARADIGM-studie) die de historische suprematie van angiotensineconverterend-enzymremmers kwam bedreigen. De verrassing was de invoering van een nieuwe entiteit tussen HFrEF en HFpEF: HFmrEF (mid-range). Voor dat nieuwe concept waren geen duidelijke bewijzen. Het betrof een grijze zone, meer bepaald een ejectiefractie van 40-50 %. Hierbij was het duidelijk de bedoeling een specifieke subgroep van patiënten te creëren om het onderzoek te stimuleren en te proberen de behandeling van die patiënten te verbeteren.
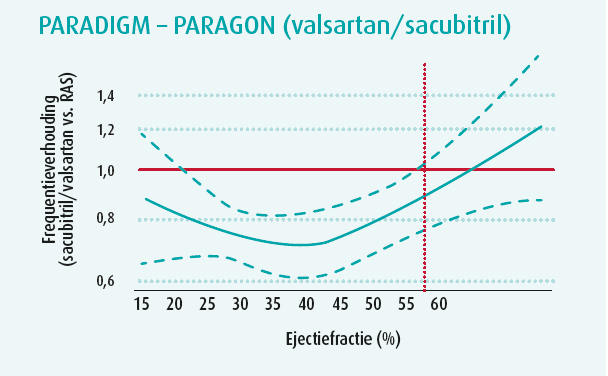
Het concept is weliswaar een grote nieuwigheid geweest in de geschiedenis van de richtlijnen, maar heeft niet geleid tot nieuwe grote multicentrische gerandomiseerde studies. Wel hebben de onderzoekers de oude studies opnieuw tegen het licht gehouden om retrospectief na te gaan of de gegevensbanken misschien toch nog niet al hun geheimen hadden prijsgegeven. Op statistisch vlak is het concept overigens vrij aanvechtbaar. Men heeft immers post-hocanalyses gaan uitgevoerd van studies waarvan de primaire uitkomstmaat negatief kon zijn. Zo kon echter toch worden achterhaald dat bètablokkers ontegensprekelijk doeltreffend zijn bij patiënten met een lage linkerventrikelejectiefractie, maar geen significant effect hebben bij een LVEF van meer dan 50 %. Bij een retrospectieve analyse van de CHARM-studie is een soortgelijke vaststelling gedaan: candesartan was doeltreffend bij patiënten met een HFrEF of HFmrEF, maar niet bij patiënten met een HFpEF. Opnieuw bedroeg de afbreekwaarde circa 50 % (figuur 1). Bij een retrospectieve analyse van de TOPCAT-studie volgens de ejectiefractie (figuur 1) werd een daling van het aantal ziekenhuisopnames wegens hartfalen vastgesteld bij patiënten met een LVEF < 60 %, maar er werd geen effect op de sterfte gezien, ongeacht de ejectiefractie.
De PARAGON-studie met valsartan-sacubitril bij patiënten met een HFpEF heeft de plank net misgeslagen: een daling van het primaire eindpunt (een samengesteld eindpunt van ziekenhuisopname wegens hartfalen en cardiovasculaire sterfte) met 13 %, op de grens van de statistische significatiedrempel (p = 0,059). Om de werkzaamheid volgens de ejectiefractie te evalueren, hebben de onderzoekers een analyse verricht van de samengevoegde gegevens van de PARADIGM- (HFrEF) en PARAGON-studie (HFpEF). Bij een LVEF < 55 % is een daling van het primaire samengestelde eindpunt vastgesteld (figuur 1). Bij mannen daalde het aantal ziekenhuisopnames wegens hartfalen enkel in geval van een linkerventrikelejectiefractie lager dan 40 %. Bij vrouwen werd zo'n daling waargenomen tot een ejectiefractie van 60 %. In beide geslachten daalde de cardiovasculaire sterfte bij patiënten met een ejectiefractie van minder dan ongeveer 45 %.

Tegen die achtergrond zijn de richtlijnen van 2021 opgesteld. Er zijn geen verrassingen wat HFrEF betreft. Naast het klassieke trio vormen SGLT2-remmers zoals empagliflozine en dapagliflozine nu een vierde pijler bij de behandeling dankzij de EMPEROR- en DAPA-HF-studie. De naam van HFmrEF is veranderd van 'middle range' naar 'mildly reduced', een subtiele nuance … Post-hocanalyses van die studies hebben eindelijk ook geleid tot therapeutische richtlijnen voor patiënten met een hartfalen met een ejectiefractie van 40 tot 50 %. Die krijgen dezelfde geneesmiddelen als patiënten met een HFrEF, maar de bewijskracht is duidelijk zwakker. In plaats van 'IA' zoals we gewoon waren bij HFrEF, hebben we nu een bewijskracht 'IIb' (kunnen worden aanbevolen) en een bewijskracht 'C' (consensus van experts, retrospectieve studies, registers enz.).
De SGLT2-remmers zijn net iets te laat gekomen om opgenomen te worden in de richtlijnen van 2021. De EMPEROR-Preserved-studie met empagliflozine bij patiënten met een ejectiefractie hoger dan 40 % is gepresenteerd op het ESC-congres in 2021 en de DELIVER-studie (met dapagliflozine in een soortgelijke populatie) heeft pas dit jaar op het ESC-congres verlossing gebracht voor die revolutionaire therapeutische klasse. De resultaten liggen volledig in de lijn met die van de overeenstemmende twee studies bij HFrEF: daling van het aantal ziekenhuisopnames wegens hartfalen met 28 % en daling van de cardiovasculaire sterfte met 13 %, ongeacht de ejectiefractie. We mogen er dus van uitgaan dat SGLT2-remmers bij de publicatie van de volgende richtlijnen voor hartfalen voor de eerste keer in klasse IA ondergebracht zullen worden, ongeacht de ejectiefractie (HFrEF, HFmrEF en HFpEF).
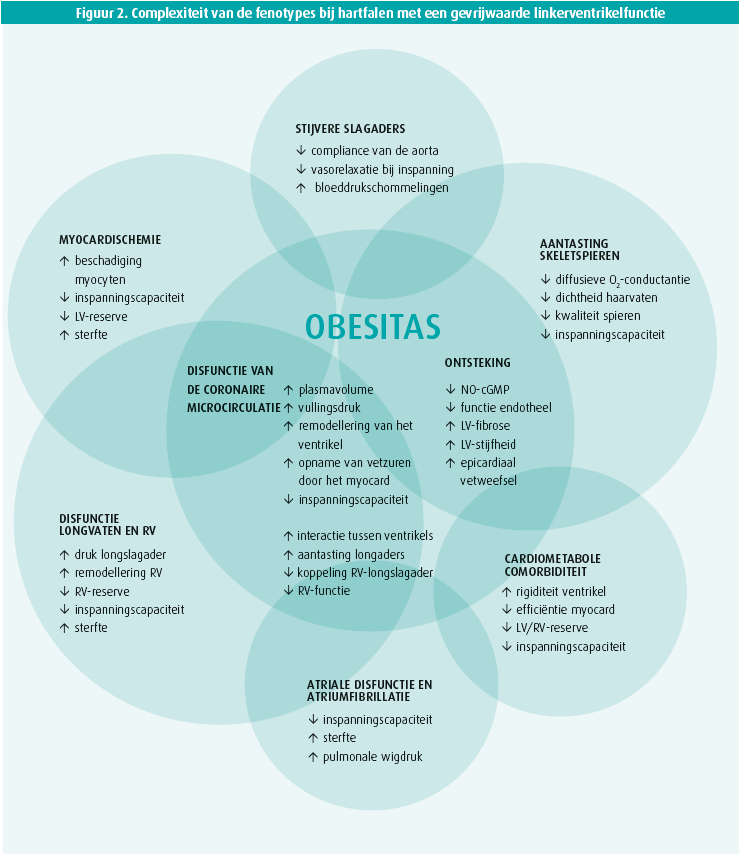
Hoe zullen patiënten met hartfalen in de toekomst worden behandeld? Waarschijnlijk zal meer rekening worden gehouden met het fenotype, vooral bij HFpEF, zeker als HFrEF beschouwd wordt als een apart fenotype en HFmrEF als een fenotype dat dichter aanleunt bij HFrEF dan bij HFpEF (maar die zullen allicht ook beter worden omschreven). Hartfalen is een klinisch syndroom, waarbij het lichaam niet in staat is een toereikend hartdebiet te verzekeren in rust en/of bij inspanning bij niet te hoge vullingsdrukken. Tal van omstandigheden kunnen samen uitmonden in zo'n klinisch syndroom (zie figuur 2). Voor een betere gerichte behandeling is het waarschijnlijk essentieel om de pathofysiologie van hartfalen met zijn comorbiditeit te omschrijven.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.