Cas clinique et revue de la littérature
Introduction
Le nombre d'implantations de pacemakers implantés s'est accru au cours des années. Il est important de rester vigilant vis-à-vis des complications potentielles de ces dispositifs. On estime le risque entre 3 % et 7,5 %; les plus fréquentes complications comprennent le pneumothorax (< 4 %), un déplacement de sonde (< 5 %) ou une perforation myocardique (< 1 %).1-2
Ce cas clinique rapporte une perforation myocardique tardive du ventricule droit par la sonde ventriculaire du pacemaker, avec un épanchement péricardique, ayant nécessité une prise en charge chirurgicale avec repositionnement de la sonde ventriculaire et drainage de l'épanchement péricardique.
Ce cas présente un intérêt particulier, car il illustre une complication rare, mais potentiellement grave, du pacemaker. De plus, cet événement était inattendu dans le suivi clinique de la patiente.
Observation clinique
Une patiente de 86 ans est connue pour une fibrillation atriale (FA) persistante à réponse ventriculaire rapide (130-140 bpm). Elle est en bon état général malgré une dyspnée à l'effort et des palpitations. On note parmi ses facteurs de risque cardiovasculaire: une hypertension artérielle et une hypercholestérolémie. En ce qui concerne les antécédents médico-chirurgicaux, on retrouve une FA paroxystique, un pontage fémoro-poplité, une hypothyroïdie et une fibrose hépatique débutante sous amiodarone. Le traitement de la patiente comprend du dabigatran 110 mg 2 x/J, losartan 100/25 mg 1 x/J, thyroxine 75 μg 1 x/J, atorvastatine 20 mg 1 x/J et de l'alprazolam 0,5 mg 1 x/J. Une cardioversion électrique externe est programmée après vérification par échographie transoesophagienne (ETO) de l'absence de thrombus dans les oreillettes. Suite à la cardioversion, un rythme sinusal est restauré après un choc diphasique unique de 300 Joules. Une maladie de l'oreillette est démasquée au retour du rythme sinusal, avec une bradycardie significative et des pauses cardiaques > 5 secondes, constituant un risque supplémentaire de trouble du rythme (torsade de pointe) au vu de la longueur du QTc (500-520 msec). Il est décidé d'implanter un pacemaker double chambre initialement programmé en mode physiologique DDD. La radiographie de thorax réalisée le lendemain de la mise en place du dispositif est normale et montre les sondes bien en place. Un contrôle du pacemaker est également réalisé le lendemain de l'intervention; les seuils de stimulation sont à 0,5 V, ce qui est tout à fait satisfaisant.
Trois mois après l'implantation du pacemaker, la patiente est revue en consultation pour un contrôle. Le seuil ventriculaire de stimulation est élevé (3,8 V) justifiant la réalisation d'une radiographie du thorax pour exclure tout déplacement de la sonde. L'échographie ne montre pas d'épanchement péricardique et pas de signe de transfixion de cette sonde ventriculaire. Le cardiologue traitant propose de ne pas intervenir sur la sonde, vu l'âge et l'état de la patiente et le faible taux de stimulation ventriculaire (< 5 %).
Au quatrième mois, la patiente est revue une nouvelle fois, avec des paramètres semblables: seuil de stimulation ventriculaire toujours élevé mais stable (3,5 V), absence de complications. Poursuite de l'abstention thérapeutique.
Sept mois après l'implantation, la patiente arrive en Salle d'urgences avec des palpitations et de la dyspnée. Elle sera hospitalisée dans le Service de cardiologie durant 13 jours. L'examen clinique est sans particularité, hormis la présence d'une récidive de FA rapide à 130-140 bpm sous amiodarone et dabigatran. Trois chocs électriques externes successifs de 300 Joules, 360 Joules et 360 Joules ne permettent pas un retour en rythme sinusal. Au 6ème jour de l'hospitalisation, le seuil de stimulation ventriculaire est encore plus élevé (5,4 V) faisant soupçonner un déplacement de la sonde. Après révision des images du scanner cardiaque, la sonde ventriculaire semble avoir migré (figure 1). Une échographie transthoracique du coeur montre un épanchement péricardique circonférentiel de maximum 15 mm. Une prise en charge chirurgicale par repositionnement de la sonde ventriculaire dans le septum ventriculaire et drainage péricardique est réalisée au 12ème jour de l'hospitalisation. Nous notons une absence de complication durant l'intervention. Le contrôle radiologique et le contrôle du pacemaker à 24 heures sont rassurants.
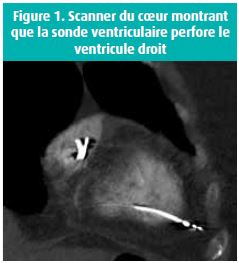
Discussion
Le nombre d'implantations de pacemakers a augmenté de 1 % par an au cours des 22 dernières années en Belgique. Entre 2007 et 2016, 20 489 pacemakers ont été implantés dans notre pays.3 Le nombre élevé d'implantations se retrouve aussi ailleurs dans les pays occidentaux: plus de 70 000 pacemakers implantés en Angleterre en 2013-2014 ou encore 250 000 pacemakers implantés chaque année aux états-Unis.1, 4
Les complications observées les plus fréquentes sont: le pneumothorax, le syndrome de Twiddler (déplacement de sonde intentionnelle), les infections, une dysfonction d'une sonde en termes de stimulation ou de détection, les thromboses veineuses (dont le plus souvent la veine sous-clavière) et la perforation du myocarde.1, 5 Cette dernière par une sonde du pacemaker est une complication rare, mais dont les conséquences peuvent être graves en termes de morbi-mortalité. La première description remonte à 1969 par Barold.5 L'incidence de la perforation myocardique par sonde de pacemaker est faible et varie de 0 % à 6,37 % en fonction des études, avec une moyenne à 0,82 % et une médiane à 0,40 %.6
Elle peut toucher la majorité des parties du coeur qui sont en contact avec les sondes. Le plus souvent, c'est au niveau de l'apex du ventricule droit que les perforations sont observées; ce site est en effet plus mince, comparé au septum interventriculaire qui est également un site alternatif d'implantation de la sonde ventriculaire.1
Les perforations myocardiques peuvent être catégorisé en aiguës (peropératoire ou dans les 24 heures qui suivent l'intervention), subaigües (durant le premier mois qui suit l'implantation) et en perforation chroniques ou retardées (au-delà du premier mois post-implantation). La majorité des perforations sont subaiguës et les plus rares sont les formes retardées ou chroniques.
La clinique est parfois peu spécifique avec des symptômes tels qu'une fatigue ou une majoration de dyspnée. Les symptômes dépendent des paramètres de stimulation et de la position secondaire de la sonde (dans le péricarde, médiastin, espace pleural, poumon ou encore dans l'abdomen). Les plaintes les plus fréquemment décrites sont la douleur thoracique, la dyspnée, la stimulation diaphragmatique, le hoquet, la syncope et la douleur abdominale. L'état hémodynamique du patient dépend principalement de la présence d'un épanchement péricardique.5 Le diagnostic est souvent fait de manière fortuite. Il est donc important d'envisager le cas devant un patient avec une douleur thoracique s'il est porteur d'un pacemaker, qu'il soit implanté depuis peu ou non.1-2, 4 La radiographie du thorax permet souvent le diagnostic, avec projection d'une sonde hors de la silhouette cardiaque (figures 2 et 3). L'échographie n'est pas souvent utile; l'étude rétrospective de Sterlinski attire l'attention sur le fait que la majorité des patients implantés avaient bénéficié d'une échographie cardiaque, qui était normale avant leur sortie de l'hôpital.7 Il ne faut donc pas être faussement rassuré par un examen échocardiographique post-implantation normal.
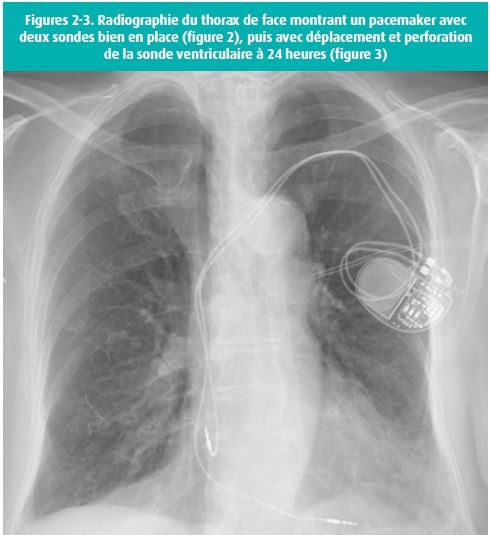
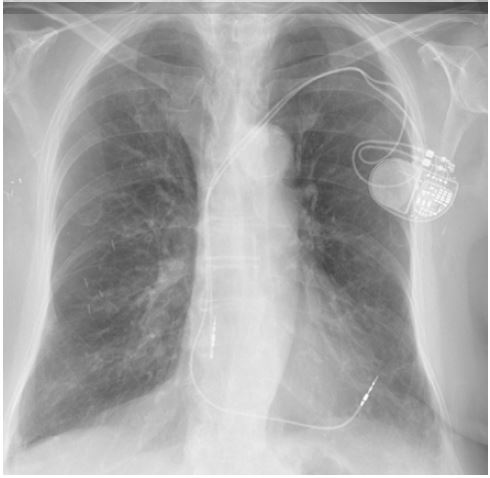
Il n'y a pas de différence significative entre le risque de perforation par la sonde atriale ou par la sonde ventriculaire.6 De plus, il n'y a pas de corrélation avec le modèle de sonde.7 Les risques de perforation peuvent être classés en trois catégories: les risques liés aux sondes moins fréquents car les sondes sont plus fines et plus flexibles; la perforation sera également plus fréquente en cas de fixation active (sonde à vis) par rapport à une fixation passive (sonde à barbillon). En second lieu, concernant les performances chirurgicales, les médecins qui réalisent moins de 50 procédures par an ont un risque de complications plus élevé. Enfin, les facteurs de risque liés aux patients sont l'âge élevé (> 80 ans), le genre féminin et un poids faible (BMI bas); on retrouve également toutes les conditions qui influencent l'état du myocarde (pression ventriculaire droite, position anatomique, séquelle d'infarctus ou autre atteinte, médicaments).4 Vanezis ajoute comme facteur de risque le site d'implantation, le site d'accès veineux ainsi que l'utilisation concomitante de stéroïdes.1 Notons également que des chirurgies cardiaques avec manipulation du coeur chez des patients porteurs d'un pacemaker sont également à risque.8
La question de la mobilisation du patient après l'implantation de pacemaker est également soulevée.9 Il n'y a pas de guidelines internationaux sur la durée d'immobilisation au lit après l'implantation. Miracapillo montre qu'une mobilisation précoce (3 heures après l'implantation) est possible et qu'il n'y a pas de différence significative avec une mobilisation tardive (24 heures après l'implantation). En effet, l'intérêt d'une immobilisation est difficile à comprendre à l'exception de quelques heures pour récupérer du stress physique de la procédure. La bonne fixation des sondes n'est pas due à l'immobilisation du patient, car les contractions continues du coeur rendent cette zone impossible à immobiliser. Il est évident que les gestes amples et brusques de l'épaule sont déconseillés, car ils peuvent exercer une légère traction sur les sondes. Le seul facteur protecteur est une pression systolique du ventricule droit > 35 mmHg, lié probablement à son association à l'hypertrophie ventriculaire droite.5
En ce qui concerne les examens complémentaires, la radiographie de thorax et l'échographie transthoracique permettent d'exclure ou de confirmer des complications telles qu'un pneumothorax ou une perforation myocardique par une visualisation des sondes.1, 2 De plus, cette échographie permet surtout de visualiser un éventuel épanchement péricardique, comme le rappelle Refaat.10 S'il existe un doute diagnostique, un scanner peut être réalisé. Banaszewski ajoute même que le scanner est le gold standard dans le diagnostic de perforation par sonde, même si cette technique a des limitations notamment liés aux artéfacts (matériel métallique).5 L'interrogation du pacemaker par un cardiologue compétant est également importante; un changement d'impédance, une augmentation du seuil de stimulation et/ou une modification de capture, un manque de sensibilité (faible amplitude détectée) ou la présence d'un bruit parasite sont suggestifs de problème lors de l'implantation et l'investigation doit être poursuivie.9 Une interrogation normale n'exclut jamais une complication tardive possible.
En ce qui concerne la prise en charge, elle peut être classée en quatre situations: une intervention cardiaque à coeur ouvert afin de colmater une brèche, un drainage péricardique avec repositionnement de sonde, un drainage péricardique sans repositionnement de sonde, ou l'abstention thérapeutique, sachant que la plupart des cas d'épanchement péricardique minime ou de péricardite se résout sans drainage et sans chirurgie.
Le positionnement de la sonde ventriculaire en position septale est aussi efficient qu'en position apicale, en ce qui concerne la stimulation, le sensing et l'impédance. C'est également un site de placement de sonde qui donne ces très rares complications (figure 4).11
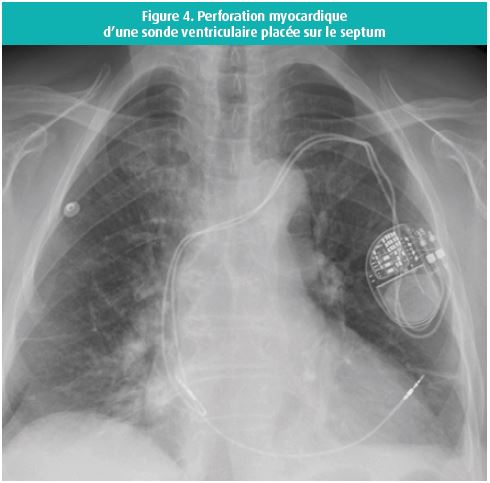
Conclusion
Notre patiente de 86 ans a souffert d'une perforation ventriculaire droite par la sonde de son pacemaker, de manière retardée et peu symptomatique. Elle présentait comme facteurs de risque le genre féminin et l'âge avancé. De plus, elle a bénéficié d'une cardioversion par choc électrique externe. Il est possible que la sonde ventriculaire ait été implantée initialement un peu trop profondément, comme l'attestent les seuils de stimulation ventriculaires assez élevés après un suivi court, et que les soubresauts brutaux du coeur lors de la cardioversion électrique aient favorisé le déplacement de la sonde ventriculaire au travers de l'apex du ventricule droit avec perforation et épanchement péricardique secondaire. Fort heureusement, le diagnostic a été posé rapidement, et la patiente a été traitée efficacement par voie chirurgicale et n'a aucune séquelle après un suivi de deux mois.
C'est donc essentiellement grâce à la bonne connaissance de cette pathologie que le clinicien réussit à évoquer ce diagnostic, confirmé secondairement par une analyse des performances du pacemaker, d'une échographie cardiaque ou encore d'un scanner.
Références
- Vanezis, A., Prasad, R., Andrews, R. Pacemaker leads and cardiac perforation. J Royal Soc Med Open, 2017, 8, 1-3.
- Rajkumar, C.A., Claridge, S., Jackson, T., et al. Diagnosis and management of iatrogenic cardiac perforation caused by pacemaker and defibrillator leads. Europace, 2017, 19, 1031-1037
- Mairesse, G., Le Polain de Waroux, J., et al. Quality assessment in Belgian arrhythmology: the Belgian heart rhythm association (BeHRA) databases. Acta Cardiol, 2019, 74, 1-8.
- Ellenbogen, K., Wood, M., Shepard, R. Delayed complications following pacemaker implantation. Pacing Clin Electrophysiol, 2002, 25, 1155-1158.
- Banaszewski, M., Stepinska, J. Right heart perforation by pacemaker leads. Arch Med Science, 2012, 8, 11-13.
- Vamos, M., Erath, J., Benz, A., Bari, Z., Duray, G., Hohnloser, S. Incidence of cardiac perforation with conventional and with leadless pacemaker systems: A systematic review and meta-analysis. J CV Electrophysiol, 2016, 28, 336-346.
- Sterlinski, M., Przybylski, A., Maciag, A., et al. Subacute cardiac perforations associated with active fixation leads. Europace, 2009, 11, 206-212.
- Tarbiat, M., Bakhshaei, M., Moradi, M. Successful management of right ventricular perforation associated with a pacemaker lead during Off-Pump CABG surgery: A Case Report. Anesth Pain Med, 2017, 7, e57799.
- Miracapillo, G., Costoli, A., Addonisio, L., et al. Early mobilization after pacemaker implantation. J Cardiovasc Med, 2006, 7, 197-202.
- Refaat, M., Hashash, J., Shalaby, A. Late Perforation by Cardiac Implantable Electronic Device Leads: Clinical Presentation, Diagnostic Clues, and Management. Clin Cardiol, 2010, 33, 466-475.
- Liang, Y., Liu, L., Chen, D., Lin, C., Fei, H., Chen, S., Wu, S. Right ventricular outflow tract septal pacing versus apical pacing: a prospective, randomized, single-blind 5-years follow-up study of ventricular lead performance and safety. Journal Huazhong University of Science and Technology, 2015, 35, 858-861.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.