Compte rendu du congrès de la BSC - S11
Insuffisance veineuse
Luc Maraglia - Société française de Phlébologie, France
L'insuffisance veineuse, qui se manifeste cliniquement sous la forme d'une maladie veineuse chronique (MVC), touche surtout les membres inférieurs et est définie comme toute anomalie veineuse morphologique ou fonctionnelle de longue durée se manifestant par des signes cliniques ou des symptômes. La MVC est liée à une insuffisance du réseau veineux superficiel, profond ou perforant.1
D'un point de vue physiopathologique, des modifications de la paroi veineuse et des valvules du système veineux superficiel entraînent une insuffisance de ces valvules, des modifications du tonus vasomoteur et un reflux. Il en résulte une hypertension veineuse, qui se manifeste surtout en position debout. La vidange dans le système veineux profond est compromise par une obstruction ou un reflux, ce qui entraîne une hypertension veineuse dans le système superficiel. L'étiologie sous-jacente est souvent une thrombose veineuse profonde (TVP). Les symptômes et les signes de ce phénomène portent le nom de syndrome post-thrombotique (SPT).
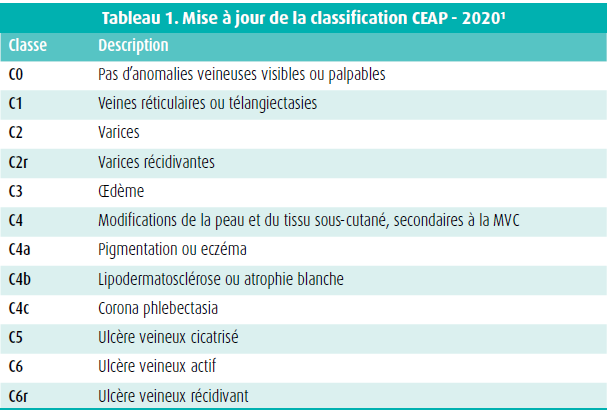
La classification CEAP (clinique, étiologique, anatomique, physiopathologique) permet de décrire la MVC dans les membres inférieurs. Sur ce plan, c'est surtout l'aspect clinique qui est pertinent pour la pratique (tableau 1).
La symptomatologie de la MVC, qui touche plus souvent les femmes, est variée et liée à l'âge. L'impact sur la qualité de vie peut être considérable. Le plus souvent, on note une sensation de lourdeur/fatigue dans les jambes. Les démangeaisons et les douleurs brûlantes sont d'autres symptômes possibles, qui augmentent typiquement en cas de station debout prolongée. Les signes cliniques et les symptômes ne sont pas nécessairement corrélés.
Récemment, la Société européenne de Chirurgie Vasculaire (ESVS) a adapté ses recommandations au sujet de la prise en charge de la MVC des membres inférieurs.1 La recherche d'antécédents thromboemboligènes et/ou d'une chirurgie de varices et l'examen clinique en position debout sont cruciaux. L'échographie Doppler (DUS) des membres inférieurs, qui constitue l'examen d'imagerie de premier choix à tous les stades, donne des informations sur l'anatomie veineuse, la perméabilité, une atteinte pariétale et le flux dans le réseau superficiel. Par ailleurs, il donne des informations sur les aspects morphologiques et hémodynamiques des veines profondes. L'établissement d'un mapping veineux (diamètres, profondeur, relation anatomique avec les artères/nerfs) est nécessaire pour la planification et la réalisation d'interventions veineuses. Lorsqu'on suspecte une pathologie veineuse supra-inguinale sur la base de l'examen clinique et des résultats spécifiques de l'écho-Doppler, on pratique un écho-Doppler abdomino-pelvien complémentaire.
Sur le plan thérapeutique, l'exercice physique, la kinésithérapie, la surélévation de la jambe et le port de semelles améliorent le retour veineux. Les modifications du style de vie comme la marche, la prévention de l'obésité et des stations debout prolongées ainsi que de l'exposition à la chaleur sont des mesures complémentaires. On recourt à la thérapie de compression (≥ 15 mmHg au niveau de la cheville) pour réduire les symptômes et l'oedème, la pression la plus élevée tolérable au niveau de la cheville assurant une efficacité maximale. Cependant, il n'est pas prouvé que ceci permet de ralentir la progression de la maladie veineuse ou d'éviter une récidive. La thérapie de compression reste toutefois la pierre angulaire du traitement conservateur de la MVC.
Il existe une indication de classe Ia pour la thérapie de compression, chez les patients présentant des ulcérations veineuses actives, la pression cible au niveau de la cheville devant atteindre au moins 40 mmHg.1 Les principales contre-indications à la thérapie de compression sont une maladie athéroscléreuse sévère avec un index cheville-bras < 0,6 ou une pression artérielle à la cheville < 60 mmHg, et une neuropathie diabétique sévère avec une atteinte sensitive ou une micro-angiopathie avec risque de nécrose cutanée.
Les veinotoniques (VAD) agissent en diminuant la perméabilité capillaire, en réduisant l'inflammation et en augmentant le tonus veineux. Ces médicaments doivent être envisagés chez les patients souffrant d'une MVC symptomatique, mais ils font l'objet de discussions.1
Le traitement interventionnel consiste en sclérothérapie, phlébectomie et ablation thermique endoveineuse. Un traitement interventionnel est indiqué (Ia) en cas d'insuffisance veineuse superficielle due à des varices symptomatiques (CEAP, C2), et lorsque l'insuffisance veineuse se manifeste par des troubles trophiques (CEAP, C4-6). Le type de traitement interventionnel dépend du cas.
En ce qui concerne le traitement de l'insuffisance de la veine saphène interne, l'ablation thermique endoveineuse (par radiofréquence ou laser), associée ou non à une phlébectomie, constitue actuellement le premier choix, alors qu'auparavant on pratiquait une chirurgie ouverte. Avec cette approche endoveineuse, une anesthésie locale est suffisante et il ne faut pas interrompre les anticoagulants.
Thrombose veineuse profonde aiguë et subaiguë
Serge Motte - Hôpital Erasme
L'anticoagulation en cas de thromboembolie veineuse (TEV) consiste en une phase aiguë et un traitement à long terme (3 mois) (tableau 2).
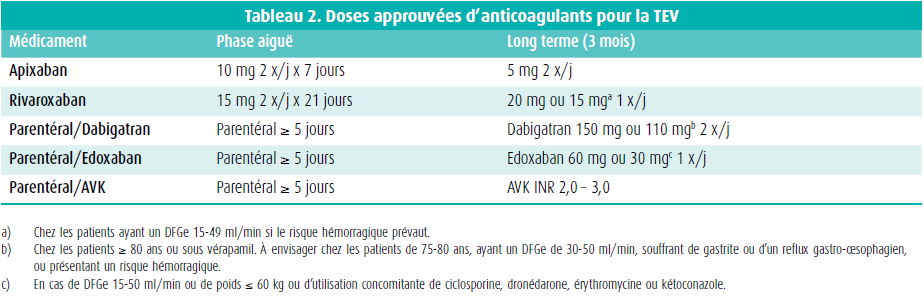
En ce qui concerne le traitement à long terme, la deuxième mise à jour des recommandations CHEST et un groupe d'experts recommandent fortement l'utilisation de DOAC par rapport aux antagonistes de la vitamine K (AVK).2 L'hospitalisation d'un patient souffrant d'une TVP est déterminée par le risque de perte du membre (indication de thrombolyse), les contre-indications absolues aux HBPM ou aux DOAC (indication de filtre cave) et l'indication d'hospitalisation en raison de comorbidités.3
Dans le cadre du traitement de la TEV, on distingue trois populations spécifiques, en l'occurrence les patients souffrant d'insuffisance rénale sévère, d'un cancer ou du syndrome des antiphospholipides (SAPL). Le registre RIETE a indiqué que 11 % des patients souffrant de TEV aiguë présentaient une insuffisance rénale sévère, avec un pourcentage plus élevé d'hémorragies majeures (odds ratio 2,26 avec un intervalle de confiance à 95 % de 2,01-2,53) comparativement aux patients indemnes d'insuffisance rénale sévère.4 Ici, l'accent est mis sur l'évitement de la dose élevée de DOAC lorsque le DFGe est compris entre 15-29 ml/min, dose qui peut en soi être utilisée en traitement initial, car il existe peu de données au sujet des DOAC dans le traitement de la TEV en cas d'insuffisance rénale sévère. Initialement, on opte préférentiellement pour l'énoxaparine à la dose de 1 mg/kg/jour, ou la tinzaparine à la dose de 175 UI/kg, lorsque la clairance de la créatinine estimée varie entre 15 et 29 ml/min.
Dans le registre RIETE, les patients cancéreux représentaient 20 % des patients souffrant d'une TEV aiguë, et ils présentaient un risque accru de morbi-mortalité.5 Une méta-analyse n'a pas pu démontrer de différence significative entre les DOAC et les HBPM en ce qui concerne l'incidence de TEV récidivante ou d'hémorragie majeure.6 Les directives CHEST mentionnent une recommandation forte pour les inhibiteurs anti-Xa oraux comparativement aux HBPM pour le traitement initial et le traitement d'entretien. En cas de tumeurs gastro-intestinales, on préfère l'apixaban ou une HBPM.2
Environ 10 % des patients souffrant d'une TEV présentent un syndrome des antiphospholipides (SAPL), avec un risque plus élevé de TEV récidivante.7,8 L'EMA plaide contre l'utilisation de DOAC chez les patients souffrant d'un SAPL. Le risque de thrombose artérielle chez les patients souffrant d'un SAPL était plus élevé lors de l'utilisation d'un DOAC (rivaroxaban) que d'un AVK.9,10 En cas de SAPL triple positif, il faut éviter d'utiliser un DOAC, alors que ce DOAC peut être poursuivi ou remplacé par un AVK en cas de SAPL non triple positif chez un patient déjà traité par DOAC.11
Anticoagulation à long terme après une TEV
Karl von Kemp - Universitair Ziekenhuis Brussel
On évalue le risque de récidive en examinant si la TEV a été provoquée ou non, et quels étaient les facteurs de risque. Ces derniers peuvent se répartir en deux catégories : transitoires et persistants. Les facteurs de risque transitoires sont par ailleurs subdivisés en facteurs de risque majeurs et mineurs (tableau 3).12 Il va de soi que le risque de récidive est mis en balance avec le risque de saignements, évaluable à l'aide du modèle ACCP, une réévaluation périodique étant essentielle.13
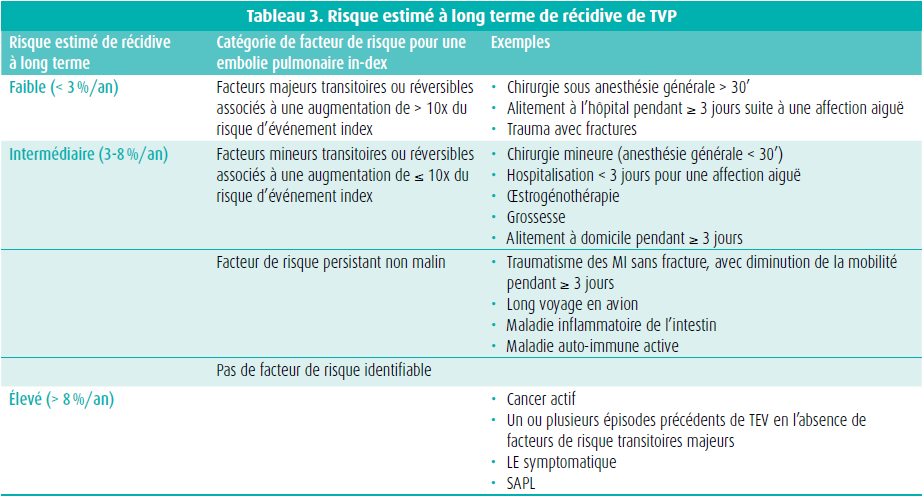
En cas de risque élevé de récidive de TEV avec un risque hémorragique faible ou intermédiaire, une anticoagulation à vie est indiquée, alors qu'elle doit au moins s'envisager en cas de risque hémorragique élevé. Dans ce dernier cas, l'indication stricte d'anticoagulation à long terme se limite aux TEV récidivantes et non provoquées.12 En cas de contre-indication absolue à l'anticoagulation ou d'embolie pulmonaire récidivante en dépit d'une anticoagulation correcte, il faut envisager un filtre cave. En cas de risque intermédiaire de récidive de TEV, il y a plusieurs possibilités. S'il s'agit d'une première TEV avec un facteur de risque persistant non malin ou d'une TEV récidivante avec un facteur de risque non malin transitoire ou persistant, on suggère une anticoagulation pendant une durée indéterminée. Une première TEV avec un facteur de risque mineur transitoire doit s'évaluer au cas par cas.12 En cas de faible risque de récidive de la TEV, il n'y a pas d'indication d'anticoagulation prolongée.
L'utilisation d'une anticoagulation de faible intensité sur l'incidence des TEV récidivantes et des hémorragies a été évaluée dans une étude avec du rivaroxaban (doses de 20 mg et 10 mg) vs de l'acide acétylsalicylique et une étude avec de l'apixaban (doses de 2 x 5 mg vs 2 x 2,5 mg) chez des patients chez qui l'indication d'anticoagulation prolongée était douteuse (risque thrombotique/ hémorragique comparable). La poursuite de l'anticoagulation après 3 mois de traitement, avec le rivaroxaban à une dose classique de 20 mg, mais aussi à une dose prophylactique de 10 mg/jour, vs 100 mg d'acide acétylsalicylique, a réduit de manière significative les récidives de TEV, sans augmentation des saignements.14 La poursuite de l'apixaban à la dose de 5 mg 2 x/j ou à une dose prophylactique de 2,5 mg 2 x/j a également réduit le risque de TEV, sans augmentation significative des hémorragies.15
Références
- De Maeseneer, M.G., Kakkos, S.K., Aherne, T., Baekgaard, N., Black, S., Blomgren, L. et al. Editor's Choice - European Society for Vascular Surgery (ESVS) 2022 Clinical Practice Guidelines on the Management of Chronic Venous Disease of the Lower Limbs. Eur J Vasc Endovas Surg, 2022, 63 (2), 184-267.
- Stevens, S.M., Woller, S.C., Kreuziger, L.B., Bounameaux, H., Doerschug, K., Geersing, G-J. et al. Antithrombotic Therapy for VTE Disease: Second Update of the CHEST Guideline and Expert Panel Report. Chest, 2021, 160 (6), 545-608.
- Khan, F., Tritschler, T., Kahn S.R., Rodger, M.A. et al. Venous thromboembolism. The Lancet, 2021, 398 (10294), 64-77.
- Catella, J., Bertoletti, L., Mismetti, P., Ollier, E., Samperiz, A., Soler, S. et al. Severe renal impairment and risk of bleeding during anticoagulation for venous thromboembolism. J Thromb Haemost, 2020, 18 (7), 1728-1737.
- Monreal, M., Falgá, C., Valle, R., Barba, R., Bosco, J., Beato, J.L. et al. Venous thromboembolism in patients with renal insufficiency: findings from the RIETE Registry. Am J Med, 2006, 119 (12), 1073-1079.
- Mulder, F.I., Bosch, F.T.M., Young, A.M., Marshall, A., McBane, R.D., Zemla, T.J. et al. Direct oral anticoagulants for cancerassociated venous thromboembolism: a systematic review and meta-analysis. Blood, 2020, 136 (12), 1433-441.
- Tromeur, C., Sanchez, O., Presles, E., Pernod, G., Bertoletti, L., Jego, P. et al. Risk factors for recurrent venous thromboembolism after unprovoked pulmonary embolism: the PADISPE randomised trial. Eur Respir J, 2017, 51 (1), 1701202.
- Kearon, C., Parpia, S., Spencer, F.A., Baglin, T., Stevens, S.M., Bauer, K.A. et al. Antiphospholipid antibodies and recurrent thrombosis after a first unprovoked venous thromboembolism. Blood, 2018, 131 (19), 2151-2160.
- Pengo, V., Denas, G., Zoppellaro, G., José, S.P., Hoxha, A., Ruffatti, A. Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome. Blood, 2018, 132 (13), 1365-1371.
- Ordi-Ros, J., Sáez-Comet, L., Pérez-Conesa, M. Vidal, Riera-Mestre, A., Castro- Salomó, A., Cuquet-Pedragosa, J. et al. Rivaroxaban Versus Vitamin K Antagonist in Antiphospholipid Syndrome: A Randomized Noninferiority Trial. Ann Intern Med, 2019, 171 (10), 685-694.
- Arachchillage, D.R.J., Gomez, K., Alikhan, R., Anderson, J.A.M., Lester, W., Laffan, M. et al. Addendum to British Society for Haematology Guidelines on Investigation and Management of Antiphospholipid syndrome, 2012 (Br. J. Haematol. 2012; 157: 47-58): use of direct acting oral anticoagulants. Br J Haematol, 2020, 189 (2), 212-215.
- Konstantinides, S.V., Meyer, G., Becattini, C., Bueno, H., Geersing, G-J., Harjola, V-P. et al. 2019 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J, 2020, 41 (4), 543-603.
- Kearon, C., Akl, E.A., Comerota, A.J. et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest, 2012, 141 (2), suppl:e419S-e494S.
- Weitz, J.I., Lensing, A.W.A., Prins, M.H., Bauersachs, R., Beyer-Westendorf, J., Bounameaux, et al. Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism. N Engl J Med, 2017, 376 (13), 1211-1222.
- Agnelli, G., Buller, H.R., Cohen, A., Curto, M., Gallus, A.S. et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med, 2013, 368 (8), 699-708.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.