Qui, quand, comment ?
La sténose aortique (SA) concerne 2,6 à 6 % des sujets de plus de 65 ans.1 Il s'agit d'une valvulopathie fréquente (12,6 millions de cas en 2017) et responsable de 102 700 décès par an.2 Sa prévalence est en hausse constante, ce qui est en partie dû à l'augmentation de l'espérance de vie.3 La SA est facilement détectée par l'auscultation cardiaque, souvent à un stade précoce, en l'absence de répercussion hémodynamique. Elle s'aggrave lentement, et sa sévérité peut être facilement évaluée par échocardiographie Doppler. Aucun traitement médicamenteux (ni les statines4, ni d'autres agents plus récents) ne permet de ralentir sa progression.5 La seule option thérapeutique est le remplacement chirurgical de la valve aortique par une prothèse mécanique ou biologique. Le développement de l'approche percutanée (transcatheter aortic valve implantation - TAVI) permet de traiter des patients à haut risque, à moyen risque et même à faible risque avec peu de complications.6
Les recommandations européennes et américaines concordent quant à l'indication d'un remplacement de la valve aortique (RVA) chez les patients qui présentent une SA sévère, lorsqu'ils sont symptomatiques (si les symptômes sont dus à la SA) ou si la fraction d'éjection ventriculaire gauche (FEVG) est < 50 %.7, 8 La prise en charge des patients asymptomatiques avec SA sévère demeure plus controversée. Les indications actuelles (critères, classes, niveaux d'évidence et limitations) sont présentées dans le tableau 1.
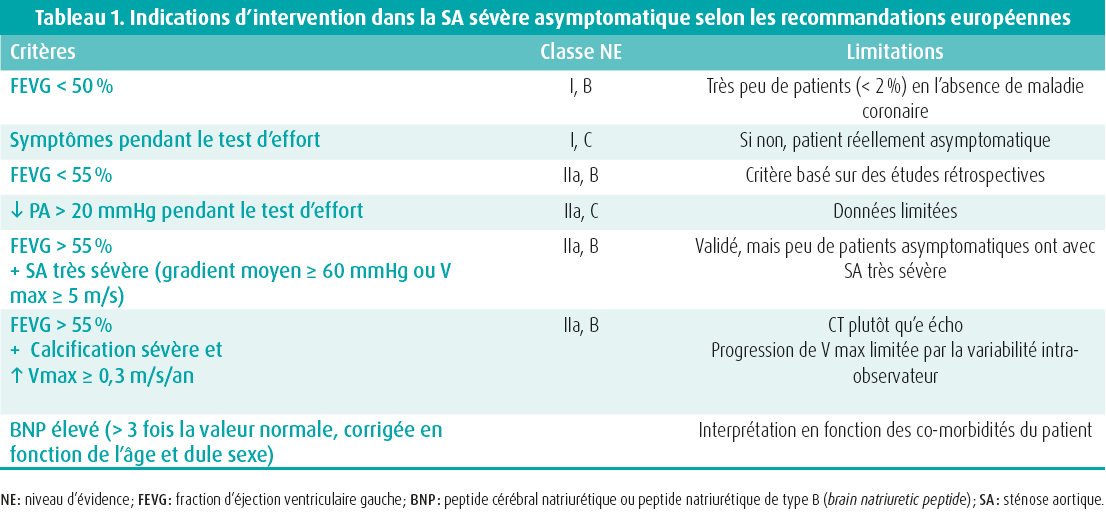
Un RVA est indiqué (classe I) si le patient a une FEVG < 50 % ou doit subir une autre intervention cardiaque (classe I). Si le patient développe des symptômes au cours d'un test d'effort (dyspnée intense, angor, lipothymie et a fortiori syncope), un RVA est également indiqué (classe I). Ce type de patients ne doit pas être considéré comme réellement asymptomatique.
Il est nécessaire, en ce qui concerne la prise en charge des patients asymptomatiques avec SA sévère, d'évaluer les risques et les bénéfices. La décision se prend à la suite d'une discussion multidisciplinaire en « heart team », idéalement dans le cadre d'une clinique des valvulopathies.9 Plusieurs questions doivent être soulevées.
Le patient est-il réellement asymptomatique ?
De nombreux patients, particulièrement les personnes âgées et les femmes,10 réduisent progressivement leurs activités physiques pour éviter les symptômes ; certains patients ne rapportent pas leurs symptômes, voire les nient parfois. C'est la raison pour laquelle le test d'effort est fortement recommandé dans le cadre de la recherche de symptômes ou pour confirmer que le patient est asymptomatique. Plusieurs études ont rapporté qu'au moins un tiers des patients qui se disent asymptomatiques développent des symptômes au cours du test d'effort et sont donc éligibles pour une intervention.11 La valeur prédictive négative d'un test d'effort normal est élevée, seule une minorité des patients devenant symptomatiques au cours d'un suivi de 12 mois ; la valeur prédictive positive est bonne (79 %) pour les patients âgés de moins de 70 ans, mais elle est seulement de 57 % dans la population plus âgée.12 Malheureusement, une enquête européenne a montré que seule une minorité (6,1 %) de patients asymptomatiques avec SA sévère étaient soumis à un test d'effort.13
La SA est-elle vraiment sévère ?
Une SA est jugée sévère quand le pic de vélocité est ≥ 4 m/s, le gradient de pression moyen est ≥ 40 mmHg, et la surface d'ouverture est < 1 cm² (ou < 0,6 cm²/m²). La surface d'ouverture peut être sous-estimée, et la sévérité de la SA, surestimée, si le diamètre de la chambre de chasse du ventricule gauche (VG) est sous-estimé (porté au carré dans l'équation de continuité). En effet, la chambre de chasse est souvent ovale plutôt que sphérique, et c'est le petit diamètre qui est mesuré par l'échocardiographie 2D. à l'inverse, le gradient de pression peut être surestimé par le phénomène de récupération de pression. De même, le pic de vélocité et donc le gradient de pression peuvent être sous-estimés, si toutes les fenêtres acoustiques ne sont pas exploitées, en particulier la voie parasternale droite. Il existe souvent une discordance entre les critères (surface d'ouverture basse, malgré un gradient de pression modéré). Il convient d'exclure des erreurs de mesure et d'utiliser des mesures supplémentaires, telles que l'index de perméabilité < 0,25 (rapport entre les vitesses maximales des flux sous-aortique et transvalvulaire) ou un score calcique par CT scan > 1 200 AU chez les femmes et > 2 000 chez les hommes.
Stratégie pour déterminer le meilleur moment d'intervention
Une fois la première étape franchie (confirmation de la sévérité de la SA en excluant les erreurs de mesure, et du caractère asymptomatique par un test d'effort normal), il importe de rechercher les marqueurs de risque d'évolution défavorable à court terme (tableau 2).

Une intervention trop précoce peut exposer le patient à des complications à long terme en relation avec la prothèse implantée : thrombose de la valve, thromboembolie, hémolyse, détérioration de la valve biologique et risque lié à une réintervention. Les complications précoces liées à l'intervention sont les suivantes : mortalité pendant ou peu après la procédure, hémorragie, nécessité d'un stimulateur cardiaque, obstruction coronaire, AVC, régurgitation paravalvulaire, découplage patient-prothèse (prothèse trop petite pour le patient).
Il est évident qu'une intervention chez un patient réellement asymptomatique ne va pas améliorer sa qualité de vie. Le risque de mort subite est faible (< 1 % par an), donc inférieur au risque de mortalité d'un RVA chirurgical.
Cependant, une intervention plus précoce peut se justifier pour diverses raisons. Lorsque la SA est sévère, l'évaluation des symptômes peut être difficile, et le suivi peut être insuffisant : un tiers des patients asymptomatiques avec SA sévère sont revus moins d'une fois par an, et ceci est associé à une mortalité accrue.14 Ce délai s'observe aussi chez les patients suivis tous les six mois dans le cadre d'une clinique des valvulopathies. Les patients ne consultent pas dès que les symptômes apparaissent ; parfois, une difficulté de mobilité peut expliquer ce délai. Par ailleurs, il existe un risque de dysfonction irréversible du VG, par fibrose myocardique.15 D'autres conséquences délétères incluent une dysfonction auriculaire gauche, une insuffisance mitrale, une hypertension pulmonaire et une insuffisance ventriculaire droite. Ces marqueurs d'évolution défavorable sont observés chez plus de la moitié des patients asymptomatiques avec SA sévère ou modérée.16 Le risque est élevé si le délai entre l'apparition des symptômes et l'intervention est trop long.17 Finalement, en cas de SA sévère, une intervention sera pratiquement toujours nécessaire, sauf en cas de futilité.18-20
études contrôlées
Deux études contrôlées et randomisées ont été publiées. La première concerne 145 patients randomisés entre RVA chirurgical et un groupe contrôle sans intervention.21 Le critère de décès à 30 jours ou de décès cardiovasculaire pendant le suivi complet est observé chez un patient dans le groupe RVA, contre 11 patients sur 72 (15,2 %) dans le groupe contrôle. Dans ce groupe, l'incidence de mort subite était de 4 % à quatre ans et de 14 % à huit ans. Il n'y a pas eu un seul cas de mortalité opératoire dans le groupe RVA, ni chez les 17 % de patients du groupe contrôle soumis à la chirurgie pour décompensation aiguë. Ces résultats exceptionnels ne sont pas nécessairement applicables dans tous les services chirurgicaux. Plusieurs limitations doivent être mentionnées : l'étude a inclus des patients relativement jeunes (âge moyen : 64 ans) dont une majorité présentait une bicuspidie aortique ; la SA était en outre très sévère chez tous les patients (pic de vélocité > 5 m/s). Certains patients devenus symptomatiques n'ont pas été opérés.
La seconde étude, AVATAR (Aortic Valve Replacement Versus Conservative Treatment in Asymptomatic Severe Aortic Stenosis) a randomisé 157 patients (âge moyen : 67 ans, SA sévère, FEVG normale et test d'effort négatif).22 Le critère d'évaluation (décès toutes causes confondues, infarctus myocardique aigu, AVC, hospitalisation pour insuffisance cardiaque) était plus bas dans le groupe chirurgical (risque relatif : 0,46). La mortalité dans le groupe chirurgical était de 1,4 %. La population incluse était limitée. L'étude a été arrêtée prématurément, ce qui est souvent associé à une surestimation du bénéfice. La mortalité cardiovasculaire était similaire (9,54 % dans le groupe chirurgie précoce, contre 9,09 % dans le groupe contrôle). Les courbes divergent seulement après 18 mois pour la mortalité toutes causes confondues et l'insuffisance cardiaque. Les indications pour une chirurgie élective dans le groupe contrôle étaient l'apparition de symptômes (60 %), la progression de la SA (16 %) et une diminution de la FEVG (4 %). Ces trois critères peuvent être identifiés facilement par un suivi régulier tous les six mois.
D'autres études contrôlées plus vastes sont en cours : ESTIMATE (Early Surgery For Patients With Asymptomatic Severe AS), early TAVR (Evaluation Of Transcatheter Aortic Valve Replacement Compared To surveillance For Patients With Asymptomatic Severe AS), EASY-AS (Early Valve Replacement In Severe, Asymptomatic Aortic Stenosis Study) et EVOLVED (Early Valve Replacement Guided By Biomarkers Of Left Ventricular Decompensation In Patients With Asymptomatic Severe Aortic Stenosis). Ces études prévoient d'inclure respectivement 360, 901, 2 844 et 1 000 patients. Leurs résultats vont certainement clarifier le moment idéal d'intervention.
Chirurgie ou traitement trans-cathéter ?
Les recommandations actuelles ne proposent pas encore le TAVI chez les patients asymptomatiques. Les résultats de l'étude Early TAVR sont attendus pour mars 2024 et pourraient changer la donne.
Les décisions doivent faire l'objet d'une discussion multidisciplinaire en « heart team », incluant un cardiologue clinicien, un cardiologue interventionnel, un chirurgien cardiaque, un spécialiste d'imagerie et de monitoring pendant les interventions, un anesthésiste et d'autres spécialistes, selon les caractéristiques du patient. Ce dernier doit être informé des risques et bénéfices, et sa préférence doit être suivie. Le choix entre chirurgie et TAVI devrait également s'appliquer pour les patients asymptomatiques porteurs de marqueurs de risque.
L'incidence de la SA sévère va considérablement augmenter dans les prochaines années et décennies. La capacité des départements de cardiologie interventionnelle et de chirurgie cardiaque pourrait être débordée, particulièrement si les patients ne sont pas évalués au moyen d'une stratégie individuelle. Les délais d'attente risquent d'être majorés.
Par ailleurs, on estime qu'un tiers des patients symptomatiques avec SA sévère et une indication de classe I ne sont pas traités par chirurgie ou TAVI. Le TAVI est en revanche souvent pratiqué chez des patients ayant peu de chances d'en bénéficier.
Conclusions
Les réponses aux questions « qui », « quand » et « comment » devraient se baser sur une approche individuelle, selon plusieurs étapes :
- Confirmer la sévérité de la SA et son caractère asymptomatique ;
- Rechercher des marqueurs de risque : SA très sévère, calcification sévère de la valve et progression rapide, peptide natriurétique de type B très élevé, FEVG < 55 %, déformation longitudinale globale < 15 %.22
- Déterminer que le patient a un faible risque de mortalité et de complications liées à la procédure ; et
- Vérifier que la durabilité de la prothèse sélectionnée est supérieure à l'espérance de vie du patient.
Certains patients asymptomatiques ne doivent pas nécessairement être soumis à une intervention, mais leur suivi doit être bien organisé, avec une surveillance régulière (tous les trois à six mois) incluant une évaluation clinique, échocardiographique et biologique, idéalement dans le cadre d'une clinique des valvulopathies.
Références
- Nkomo, V.T., Gardin, J.M., Skelton, T.N., Skelton, T.N., Gottdiener, J.S., Scott, C.G. et al. Burden of valvular heart disease: a population-based study. The Lancet, 2006, 368 (9540), 1005-1011.
- Yagdir, S., Johnson, C.O., Aboyans, V., Adebayo, O.M., Adedoyin, R.A., Global, Regional, and National Burden of Calcific Aortic Valve and Degenerative Mitral Valve Diseases, 1990-2017. Circulation, 2020, 141 (21), 1670-1680.
- Timmis, A., Vardas, P., Townsend, N., Torbica, A., Katus, H., De Smedt, D. et al. European Society of Cardiology: cardiovascular disease statistics 2021. Eur Heart J, 2022, 43 (8), 716-799.
- Zhao, Y., Nicoll, R., He, Y.H., Henein, M.Y. The effect of statins therapy in aortic stenosis: Meta-analysis comparison data of RCTs and observationals. Data Brief, 2016, 7, 357-361.
- Pawade, T.A., Doris, M.K., Bing, R., White, A.C., Forsyth, L., Evans, E. et al. Effect of Denosumab or Alendronic Acid on the Progression of Aortic Stenosis: A Double-Blind Randomized Controlled Trial. Circulation, 2021, 143 (25), 2418-2427.
- Vahanian, A., Beyserdorf, F., Praz, F., Milojevic, M., Baldus, S., Bauersachs, J. et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2022, 43 (7), 561-632.
- Otto, C.M., Nishimura, R.A., Bonow, R.O., Carabello, B.A., Erwin, J.P., Gentile, F. et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation, 2020, 143 (5), e72e227.
- Zilberszac, R., Lancellotti, P., Gilon, D., Gabriel, H., Schemper, M., Maurer, G. et al. Role of a heart valve clinic programme in the management of patients with aortic stenosis. Eur Heart J Cardiovasc Imaging, 2017, 18 (2), 138-144.
- Desjardin, J.T., Chikwe, J., Hahn, R.T., Hung, J.W., Delling, F.N. Sex Differences and Similarities in Valvular Heart Disease. Circ Res, 2022, 130 (4), 455-473.
- Rafique, A.M., Biner, S., RayI, I., Forrester, J.S., Tolstrup, K., Siegel, R.J. Meta-analysis of prognostic value of stress testing in patients with asymptomatic severe aortic stenosis. Am J Cardiol, 2009, 104 (7), 972-977.
- Das, P., Rimington, H., Chambers, J. Exercise testing to stratify risk in aortic stenosis. Eur Heart J, 2005, 26 (13), 1309-1313.
- Lung, B., Delgado, V., Rosenhek, R. et al. EORP VHDII investigators. Contemporary Presentation and Management of Valvular Heart Disease: The EURObservational Research Programme Valvular Heart Disease II Survey. Circulation, 2019, 140 (14), 1156-1165.
- Ahmed, S.V., Sorajja, P., Garberich, R.F., Farivar, R.S. Harris, K.M., Gössl, M. Association of Guideline Adherence for Serial Evaluations With Survival and Adverse Clinical Events in Patients With Asymptomatic Severe Aortic Stenosis. JAMA Cardiol, 2017, 2 (10), 1141-1146.
- Kwak, S., Everett, R.J., Treibel, T.A., Yang, S., Hwang, D., Ko, T. et al. Markers of Myocardial Damage Predict Mortality in Patients With Aortic Stenosis. J Am Coll Cardiol, 2021, 78 (6), 545-558.
- Tastet, L., Tribouilloy, C., Maréchaux, S., Mara Vollema, E., Delgado, V., Salaun, E. et al. Staging Cardiac Damage in Patients With Asymptomatic Aortic Valve Stenosis. J Am Coll Cardiol, 2019, 74 (4), 550-563.
- Elbaz-Greener, G., Masih, S., Fang, J., Ko, D.T., Lauck, S.B., Webb, J.G. et al. Temporal Trends and Clinical Consequences of Wait Times for Transcatheter Aortic Valve Replacement: A Population-Based Study. Circulation, 2018, 138 (5), 483-493.
- Puri, R., Iung, B., Cohen, D.J., Rodés-Cabau, J. TAVI or No TAVI: identifying patients unlikely to benefit from transcatheter aortic valve implantation. Eur Heart J, 2016, 37 (28), 2217-2225.
- Parik, P.B. Predicting Futility in Aortic Stenosis: What's the Holdup? J Am Coll Cardiol, 2022, 80 (8), 801-803.
- Minha, S., Marcus, G. Can We Truly Predict Futility for TAVR Based on Pre-Procedural Indices? Cardiovasc Revasc Med, 2021, 23, 77-78.
- Kang, D.H., Park, S.J., Lee, S.A. Lee, S., Kim, D-H., Kim, H-K. et al. Early Surgery or Conservative Care for Asymptomatic Aortic Stenosis. N Engl J Med, 2020, 382 (2), 111-119.
- Banovic, M., Putnik, S., Penicka, M., Doros, G., Deja, M.A., Kockova, R. et al. Aortic Valve Replacement Versus Conservative Treatment in Asymptomatic Severe Aortic Stenosis: The AVATAR Trial. Circulation, 2022, 145 (9), 648-658.
- Magne, J., Cosyns, B., Popescu, B.A., Carstensen, H.G., Dahl, J., Desai, M.Y. et al. Distribution and Prognostic Significance of Left Ventricular Global Longitudinal Strain in Asymptomatic Significant Aortic Stenosis: An Individual Participant Data Meta-Analysis. JACC Cardiovasc Imaging, 2019, 12 (1), 84-92.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.